
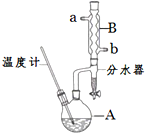
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:| 相对分子质量 | 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
分析 (1)步骤①中浓硫酸和正丁醇的添加顺序类似浓硫酸的稀释;
(2)冷凝水的水流方向和气流方向相反,下口进,上口出;
(3)在反应混合物中,浓硫酸能溶解于水,正丁醚不溶,正丁醇微溶于水,所以步骤③的目的是初步洗去浓硫酸;分液漏斗中振荡静置后,上层液体中为密度比水小的正丁醚和正丁醇,从分液漏斗的上口倒出;
(4)步骤③巾最后一次水洗的目的为洗去有机层残留的NaOH及中和反应生成的盐;
(5)步骤⑤中,加热蒸馏的目的是收集正丁醇,而正丁醇的沸点为142℃;
(6)液体混合物加热会蒸发出,经过冷凝器降温转化为液体,由于正丁醇的密度比水小且微溶于水,故正丁醇在上层,水在下层;
(7)实验前提供的37g正丁醇的物质的量为$\frac{37g}{74g/mol}$=0.5mol,根据方程式中正丁醇与正丁醚的相互关系可知正丁醚的理论产物物质的量为$\frac{0.5mol}{2}$=0.25mol,对应正丁醚的质量为0.25mol×130g•mol-1=32.5g,据此计算正丁醚的产率.
解答 解:(1)步骤①中浓硫酸和正丁醇的添加顺序类似浓硫酸的稀释,
故答案为:先加入正丁醇,再加入浓硫酸;
(2)冷凝水的水流方向和气流方向相反,下口进,上口出,
故答案为:b;
(3)在反应混合物中,浓硫酸能溶解于水,正丁醚不溶,正丁醇微溶于水,所以步骤③的目的是初步洗去浓硫酸;分液漏斗中振荡静置后,上层液体中为密度比水小的正丁醚和正丁醇,从分液漏斗的上口倒出,
故答案为:浓硫酸;上;
(4)步骤③巾最后一次水洗的目的为洗去有机层残留的NaOH及中和反应生成的盐,
故答案为:洗去有机层中残留的NaOH及中和反应生成的盐;
(5)步骤⑤中,加热蒸馏的目的是收集正丁醇,而正丁醇的沸点为142℃,故应收集142℃左右的馏分,
故答案为:d;
(6)分水器中收集到液体物质,因正丁醇密度比水小且微溶于水,会分为上下两层,上层为正丁醇,下层主要成分为水,
故答案为:正丁醇;水;
(7)实验前提供的37g正丁醇的物质的量为$\frac{37g}{74g/mol}$=0.5mol,根据方程式中正丁醇与正丁醚的相互关系可知正丁醚的理论产物物质的量为$\frac{0.5mol}{2}$=0.25mol,对应正丁醚的质量为0.25mol×130g•mol-1=32.5g,正丁醚的产率为$\frac{11}{32.5}$×100%=34%,
故答案为:34%.
点评 本题考查实验的基本操作,混合物的分离操作,重点考查分液、蒸馏操作,有关物质的量基本计算和产率的计算等,关注基础考查,中等难度.


科目:高中化学 来源: 题型:解答题
 有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:
有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等离子,现分别取溶液进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在高温下不容易自发进行 | B. | 升高温度,混合气体的密度增大 | ||
| C. | 压缩容器,反应吸收的热量不变 | D. | 分离出部分MgO,可增大CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物均属于金属氧化物 | |
| B. | 根据电解质在水溶液中的导电性强弱,将电解质分为强电解质和弱电解质 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、胶体和浊液 | |
| D. | 稀豆浆、雾、FeCl3溶液均为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2Cu(OH)2$\stackrel{△}{→}$c
+2Cu(OH)2$\stackrel{△}{→}$c +Cu2O↓+2H2O.
+Cu2O↓+2H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com