
【题目】有关物质的转化关系如图所示(部分物质与条件己略去)。已知A、C是由两种相同元素组成的物质,其中A的摩尓质量为65g·mol-1,C是白色粉末且焰色反应呈黄色,I是最常见的液体,E是一种红棕色气体,B、F都是无色气体单质。请回答下列问题:

(1)K的电子式为:___________________________。
(2)E的化学式为:___________________________。
(3)写出反应①的化学方程式:___________________________。
(4)写出反应②的离子方程式:________________________。
【答案】![]() NO2 3NaN3
NO2 3NaN3 ![]() Na3N + 4N2↑ 3NO2 + H2O = 2H+ + 2NO3-+ NO
Na3N + 4N2↑ 3NO2 + H2O = 2H+ + 2NO3-+ NO
【解析】
I是最常见的液体,E是一种红棕色气体,可知I为水,E为二氧化氮,二氧化氮与水反应生成一氧化氮(D)和硝酸(J),B、F都是无色气体单质,B为氮气,K为氨气,C是白色粉末且焰色反应呈黄色,为含有钠元素和氮元素的化合物,其与A物质组成元素相同,已知A摩尔质量为65g·mol-1,可以推知化合物A为NaN3,根据氧化还原反应规律,由于B为氮气,为氧化产物,所以C为还原产物,氮元素价态降低,所以C为Na3N。
(1)根据以上分析可知K为氨气,其电子式为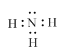 ,
,
故答案为: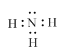 ;
;
(2)根据以上分析可知E为二氧化氮,化学式为NO2,
故答案为:NO2;
(3)反应①为NaN3受到撞击后分解为氮气和Na3N,化学方程式为3NaN3 ![]() Na3N + 4N2↑,
Na3N + 4N2↑,
故答案为:3NaN3 ![]() Na3N + 4N2↑;
Na3N + 4N2↑;
(4)反应②为二氧化氮与水反应生成一氧化氮和硝酸,所以离子方程式为3NO2 + H2O = 2H+ + 2NO3-+ NO,
故答案为:3NO2 + H2O = 2H+ + 2NO3-+ NO。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;Y原子的价电子(外围电子)排布为msnmpn;②R原子核外L层电子数为奇数;③Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________,其中心原子的杂化类型是________。
(6)某元素原子的价电子构型为3d54s1,该元素属于________区元素,元素符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (x)
(x)![]() (y)
(y)![]() (z)的分子式均为C8H8,下列说法正确的是
(z)的分子式均为C8H8,下列说法正确的是
A. x、y、z均能使Br2的CCl4溶液褪色
B. x的同分异构体只有y和z
C. x、y、z的二氯代物均只有三种
D. x、y、z中只有y中所有原子可以处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向2 L恒容密闭容器中充入1 mol NO2与2 mol SO2发生如下反应:
NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1。
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1。
(1)下列能说明该反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗n mol SO3的同时生成n mol NO2
(2)反应进行到20 s 时,测得反应速率v(NO) =" 0.005" mol·L-1·s-1,则消耗的NO2为 mol。
(3)下列措施能使反应加快的是 (仅改变一个条件)
a.降低温度 b.缩小容积 c.使用效率更高的催化剂
(4)若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将 。
a.延长 b.缩短 c.不变 d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应对应的离子方程式正确的是 ( )
A. 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO===CaCO3↓+CO![]() +2H2O
+2H2O
B. 向含0.1 mol NaOH和0.1 mol Na2CO3的溶液中加入1 L 0.2 mol·L-1稀盐酸:OH-+CO![]() +3H+===CO2↑+2H2O
+3H+===CO2↑+2H2O
C. 硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
D. 向100 mL 0.12 mol·L-1的Ba(OH)2溶液中通入0.02 mol CO2:Ba2++3OH-+2CO2===HCO+BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
B. 常温常压下,14gC2H4和C4H8混合气体含有的碳原子数为NA
C. 标准状况下,4.48 L HF所含的分子数目为0.2NA
D. 在氢氧化铁胶体的制备中如果有1 mol 三氯化铁水解,则氢氧化铁胶粒数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期主族元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子均为10电子粒子,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图所示。
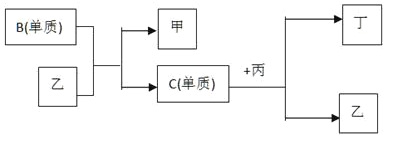
(1)根据以上条件可以确定A、B、C、D四种元素中的三种元素。不能被确定的第四种元素是____(填A、B、C、D中的一种)。
(2)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应;②甲、丙都是无色、有刺激性气味的物质。据此,写出C+丙=乙+丁的化学方程式:___________。
(3)NH3H2O的电离方程式为NH3H2O![]() NH4++OH-,试判断NH3溶于水后形成的NH3H2O的合理结构 ________(填字母代号)。
NH4++OH-,试判断NH3溶于水后形成的NH3H2O的合理结构 ________(填字母代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢加合物(xNa2SO4 ·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.77g样品,配制成100.00mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的氯化钡溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.0025mol。
③准确量取25.00mL溶液A,加入适量的稀硫酸酸化后,用0.02mol·L-1 KMnO4溶液滴定至终点(KMnO4只与加合物中的H2O2发生反应),消耗KMnO4溶液25.00mL。回答下列问题:
(1)在步骤①中,所需玻璃仪器除了烧杯外还需要________________;
(2)在步骤①中,下列操作会使所配溶液浓度偏低的是_______(填字母);
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视仪器上的刻度线
C.定容后震荡摇匀静置,发现液面低于刻度线,于是又加入少量水至刻度线
D.配制前容量瓶中有少量水
(3)③中的KMnO4溶液置于_______(“酸式”或“碱式”)滴定管中,滴定终点的现象是____________________,写出滴定中发生的离子反应方程式_______________;
(4)通过计算确定样品的组成为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯A,其分子式为C6H12O2,已知 ,又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A的结构可能有
,又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A的结构可能有
A. 3种 B. 4种 C. 5种 D. 6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com