
| ||
| 400℃ |
| ||
| 400℃ |
| 1 |
| 4 |
| 3 |
| 4 |
| ||
| 400℃ |
| ||
| 400℃ |
| 1 |
| 4 |
| 4 |
| 6 |
| 8 |
| 6 |
| 3 |
| 4 |
| 7 |
| 6 |
| 7 |
| 6 |


科目:高中化学 来源: 题型:
| A、该反应属于复分解反应 |
| B、该反应不是氧化还原反应 |
| C、若管道漏气遇氨就会产生白烟 |
| D、生成1 mol N2有3 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (提示:环丁烷
(提示:环丁烷 可简写成
可简写成 )
)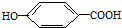 ),其反应类型
),其反应类型查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3 |
| B、SO42- |
| C、NH4+ |
| D、Br |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、邻二甲苯 |
| B、2,2,3-三甲基丁烷 |
| C、2-氯-1,3-丁二烯 |
| D、2,2-二甲基-1,3-丙二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 (g)
(g)| FeSO4/Al2O3 |
| 高温 |
 (g)+3H2(g)
(g)+3H2(g)查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是一个电解池装置,U型管内装有V L CuSO4溶液(足量);X、Y是两块电极板,通过导线与直流电源相连,请回答以下问题:
如图是一个电解池装置,U型管内装有V L CuSO4溶液(足量);X、Y是两块电极板,通过导线与直流电源相连,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铁胶体中滴加盐酸 |
| B、偏铝酸钠溶液中加盐酸 |
| C、氯化铝溶液中滴加氢氧化钠溶液 |
| D、氯化铝溶液中滴加氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com