
 按图1装置实验,若图2中x轴表示流入阴极的电子的物质的量,则y轴可表示的物理量为( )
按图1装置实验,若图2中x轴表示流入阴极的电子的物质的量,则y轴可表示的物理量为( )| A、①③ | B、③④ |
| C、①②④ | D、①②⑤ |


科目:高中化学 来源: 题型:
| A、室温下,16g O2和O3的混合气体中含有NA个氧原子 |
| B、2.24L HCl气体中含有0.1NA个HCl分子 |
| C、将0.1mol FeCl3溶于1L水中,所得溶液中含有0.1NA个Fe3+ |
| D、25℃时,1L pH=13的Ba(OH)2溶液中含有0.2 NA个OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4溶液中加入H2O2溶液的反应:Fe2++2H2O2+4H+═Fe3++4H2O |
| B、泡沫灭火器的反应原理为:Al3++3HCO3-═Al(OH)3↓+3CO2↑ |
| C、向明矾水溶液中滴加氢氧化钡溶液使SO42-恰好完全沉淀的反应:2Ba2++Al3++2SO42-+3OH-═2BaSO4↓+Al(OH)3↓ |
| D、将溴单质与少量铁加热反应的生成物溶于水,通入足量氯气后发生的反应:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中:c(Ca2+)=c(N03-) |
| B、将0.2mol?L-1 NaA溶液和0.1mol?L-1盐酸等体积混合所得的碱性溶液中(A-为酸根离子):c(Na+)>c(A-)>c(Cl-)>c(OH-) |
| C、0.1mol/L NaAl02溶液中:c(Na+)>c(A102-)>c(OH-)>c(H+) |
| D、浓度均为0.1mo1?L-1的CH3COOH、CH3COONa的混合溶液中:2c(OH-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46gNO2与46gN2O4中所含原子总数相等,为3NA |
| B、1molNa2O2与足量水充分反应,转移电子总数为2NA |
| C、32gCH4中含有“C-H”键总数为8NA |
| D、标准状况下,11.2L NH3溶于1L水,溶液中含有N原子的微粒总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的c(H+)为1×10-4 mol?L-1 |
| B、该溶液lmL稀释至100mL后,pH等于6 |
| C、向该溶液中加入等体积、pH为10的氢氧化钠溶液恰好完全中和 |
| D、该溶液中醋酸电离出的c(H+)与水电离出的c(H+)的比值为106 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O.1mol过氧化钠与足量水反应生成的O2分子数为0.1 NA |
| B、1OOmL 2.0mol?L- 1的醋酸溶液中氢离子数为0.2NA |
| C、室温下,30g由CH2O和C2H4O2组成的混合物中含有的碳原子数为NA |
| D、11.6g苯酚钠(C6H5ONa)溶解于水,溶液中C6H5O-离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
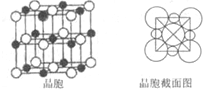 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②③ | D、①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com