
分析 NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫,所以反应方程式为:2NH4HS+O2═2NH3•H2O+2S↓;当消耗标况下22.4升富氧空气时氧气的体积为11.2L,所以氧气的物质的量为0.5mol,据此进行计算.
解答 解:H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2═2NH3•H2O+2S↓,
当消耗标况下22.4升富氧空气时氧气的体积为11.2L,所以氧气的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,所以转移电子数为:0.5mol×4=2mol,
故答案为:2NH4HS+O2═2 NH3•H2O+2S↓;2.
点评 本题考查了氧化还原反应,题目难度不大,明确氧化还原反应的特征为解答关键,注意掌握有关氧化还原反应的计算方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
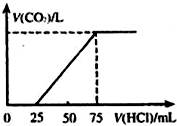 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 就地在田间焚烧秸秆,减少运输成本 | |
| B. | 烧煤进行脱硫、脱硝处理,减少空气污染 | |
| C. | 推广和鼓励多使用私家车出行 | |
| D. | 做好空气质量预报工作,以使污染程度高是好预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗硅是由焦炭和二氧化硅在电炉中反应制得 | |
| B. | 硅的化学性质不活泼,常温下只与F2、HF、强碱反应 | |
| C. | 单质硅的主要用途为制造半导体材料和硅合金的原料 | |
| D. | SiO2制成的玻璃纤维,由于电能力强而被用于制造光缆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L醋酸钙溶液中,c (Ca 2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 体积和pH 都相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 | |
| C. | 将nmolH2(g)、nmol I2(g)和2nmolH2(g)、2nmolI2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,该溶液的pH一定为14-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3kJ热量 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com