
铜和镁的合金4.6g完全溶于浓硝酸,若反应后硝酸被还原只产生 2.24L的 NO2气体和1.12L的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为()
A. 9.02g B. 8.51g C. 8.00g D. 7.04g
考点: 有关混合物反应的计算.
分析: 最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,根据电子转移守恒计算金属失去电子物质的量,沉淀质量等于金属质量与氢氧根离子质量之和.
解答: 解:2.24L的 NO2气体的物质的量为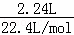 =0.1mol,1.12L的N2O4气体物质的量为
=0.1mol,1.12L的N2O4气体物质的量为 =0.05mol,根据电子转移守恒,金属失去电子物质的量0.1mol×1+0.05mol×2×1=0.2mol,
=0.05mol,根据电子转移守恒,金属失去电子物质的量0.1mol×1+0.05mol×2×1=0.2mol,
最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,故沉淀质量为4.6g+0.2mol×17g/mol=8.0g,
故选C.
点评: 本题考查混合物计算,侧重解题方法与分析思维能力的考查,注意利用守恒法解答,难度中等.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
在密闭容器中发生如下反应:mA(g)+nB(g)⇌pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的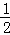 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是()
,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是()
A. m+n>p B. 平衡向逆反应方向移动
C. A的转化率提高 D. C的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去下列物质中含有的少量杂质(括号中)填写出所用试剂或方法.
(1)CO(CO2) 试剂 ,操作方法的名称 .
(2)Cu粉(Zn粉) 试剂 ,操作方法的名称 .
(3)自来水(Fe3+) 操作方法的名称 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:SO2(g)+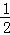 O2(g)⇌SO3(g)△H=﹣98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为()
O2(g)⇌SO3(g)△H=﹣98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为()
A. 196.64kJ B. 196.64kJ/mol C. <196.64kJ D. >196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是()
A. Mg片作负极,电极反应:Mg﹣2e﹣=Mg2+
B. 电子从Mg电极沿导线流向Al电极
C. Al片作负极,电极反应:Al+4OH﹣﹣3e﹣=AlO2﹣+2H2O
D. Al片上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定某铜银合金的成分,将30.0g合金溶于80ml13.5mol/L的浓硝酸中,待合金完全溶解后,收集到标况气体6.72L,并测得溶液的C(H+)=1moL/L,假设反应后溶液的体积仍为80mL,计算:
(1)被还原的硝酸的物质的量.
(2)合金中银的质量分数.
查看答案和解析>>
科目:高中化学 来源: 题型:
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
|
| A. | 铜铸塑像上出现铜绿 |
|
| B. | 铁制菜刀生锈 |
|
| C. | 大理石雕像被酸雨腐蚀毁坏 |
|
| D. | 铝锅表面生成致密的氧化膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在100mL含等物质的量的HI和H2SO3的溶液里通入0.14molCl2,有三分之一的HI变为I2(已知:I2+H2SO3+H2O=4H++SO42﹣+2I﹣).原溶液中HI和H2SO3的浓度都等于( )
|
| A. | 8.0mol•L﹣1 | B. | 0.12mol•L﹣1 | C. | 0.8mol•L﹣1 | D. | 1.2mol•L﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂(括号内为杂质)有关操作,其中正确的是( )
|
| A. | 苯 (苯酚)﹣﹣加入适量浓溴水,过滤 |
|
| B. | NO (NO2)﹣﹣通过水洗、干燥后,用向下排空气法收集 |
|
| C. | 乙烷 (乙烯)﹣﹣让气体通过盛有酸性高锰酸钾溶液的洗气瓶 |
|
| D. | 乙醇 (乙酸)﹣﹣加足量CaO固体,蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com