
| A. | MgCl2 | B. | Na2O2 | C. | H2O | D. | N2 |
科目:高中化学 来源: 题型:选择题
 用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 阴极的电极反应式为:Cl-+2OH--2e -=ClO-+H2 O | |
| B. | 阳极的电极反应式为:2CN-+12OH--10e-=N2↑+2CO 32-+6H2O | |
| C. | 电解时使用锂钒氧化物二次电池(V2O5+xLi$?_{充电}^{放电}$LixV2O5)做电源,电池充电时a 电极的电极反应式为:LixV2O5_xe-=V2O5+xLi+ | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 燃料电池的正极反应式为:O2+2H2O+4e-=4OH- | |
| B. | 装置中NaOH溶液的作用是吸收产生的有毒气体氯气 | |
| C. | 装置中的电子流动路径为:负极→外电路→阴极→苦卤水→阳极→正极 | |
| D. | 理论上,当b 极周围产生2g H2,电池消耗C6H12O6的质量为15g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
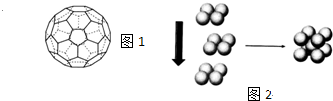
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
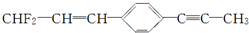 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 该有机物物质的类别为:卤代烃、烯烃、炔烃 | |
| B. | 该有机物分子式:C12H9F2 | |
| C. | 最多有8个碳原子在同一直线上 | |
| D. | 12个碳原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3,K2O,C4H10 | B. | CH4,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com