
【题目】如图为乙酸丁酯制备的实验装置,下列说法正确的是
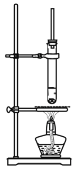
A.玻璃导管的主要作用是平衡试管内外压强
B.该装置适用于乙酸乙酯的制备
C.加入过量乙酸可以提高丁醇的转化率
D.分离提纯乙酸丁酯的方法是将混合物直接分液
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】下列有关溶质的质量分数和物质的量浓度的计算结果错误的是
A.密度为0.91g/cm3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液中溶质的质量分数等于12.5%
B.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol/L ,SO42-的物质的量浓度为0.7 mol/L ,则此溶液中K+的物质的量浓度为0.2 mol/L
C.将5 mol/L 的Mg(NO3)2溶液amL 稀释至bmL,稀释后溶液中NO3-的物质的量浓度为![]() mol/L
mol/L
D.将标准状况下,将VL A气体(摩尔质量为Mg/mol)溶于0.1L水中,所得溶液密度ρg/cm3,则此溶液的物质的量浓度为![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是生产和生活中用量较多的金属。
(1)下列有关铜元素的说法中,不正确的是__________(填字母)
A.青铜、不锈钢、硬铝都是合金
B.铜表面易形成致密的氧化膜
C.铜与O2反应生成黑色的CuO
D.CuSO4·5H2O是一种混合物,加热后变为白色固体
(2)某化学小组为测定某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
①请写出方案Ⅰ中铜与稀硝酸反应的离子方程式:___________,该方案中稀硝酸表现出来的性质是___________(填字母)。
A.挥发性 B.酸性 C.氧化性 D.还原性
②方案Ⅱ比方案Ⅰ更易于实施,理由是________________。请写出方案Ⅱ中发生反应的化学方程式:____________,该反应产生气体在标准状况下的体积为________(铜铝混合物质量是m1g,反应后剩余固体的质量m2g,用含m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸及其盐溶液有杀菌、消毒、漂白的作用。在此次抗击新冠疫情中发挥了巨大作用。某学习小组根据需要欲制备浓度不小于0.8mol·L-1的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水,且会与水反应生成次氯酸。
资料2:Cl2O的沸点为3.8℃,42℃以上会分解生成Cl2和O2;Cl2的沸点为-34.6℃
该小组用Cl2与潮湿的碳酸钠制取Cl2O,并进一步制取次氯酸,装置如下。
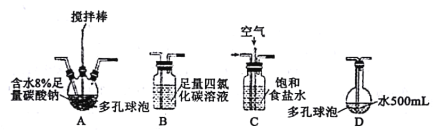
回答下列问题:
(1)装置连接顺序为Cl2→___。(用字母表示)
(2)装置A中反应的化学方程式是___。
(3)装置B的作用___,整个实验加快反应速率所采用的方法有___。
(4)装置D中反应的化学方程式是___。
(5)如果要收集Cl2O,则可以在B装置后连接E装置进行收集,这样做的依据是什么___,逸出气体的主要成分是___。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是___(答出一条即可)。
(7)测定反应完成后A中物质的质量分数:取mg样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1molL-1的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2mL。
①则由上述实验可测定反应完成后A中物质的质量分数为___(说明具体物质并用含m、V1和V2的代数式表示)。
②若用甲基橙作指示剂滴定结束时,滴定管尖嘴有气泡,对测定结果的影响是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同化学元素组成的化合物示意图,下列说法正确的是( )
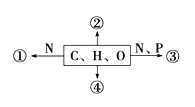
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②广泛分布在动物细胞内,则其一定是糖原
C. 若③为生物大分子,则其彻底水解产物最多为4种
D. 若④为重要储能物质,则动物和植物细胞都含有这种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)金属性最强的元素是_______;
(2)F的原子结构示意图是________;
(3)地壳中含量最多的元素是_______;
(4)Ne原子的最外层电子数是_______;
(5)N与O原子半径较大的是_______;
(6)H2S与HCl热稳定性较弱的是______;
(7)Na2O与MgO难与水反应的是______;
(8)Mg(OH)2与Al(OH)3能与强碱反应的是______;
(9)用于制造光导纤维的物质是______(填“Si”或“SiO2”);
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为____,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-SOCl2电池采用LiAlCl4的SOCl2溶液为电解质溶液,是目前比能量最高的化学电源,具有电压高.储存寿命长.工作温度范围宽.成本低等优点。
(1)该电池的工作原理为:4Li+2SOCl2=4LiCl↓+SO2↑+S↓,该反应的还原产物为__________,若生成标准状况下气体11.2L,则转移电子的数目为_____________;
(2)SOCl2可用于AlCl3·6H2O制备无水AlCl3,请结合离子方程式解释不采用直接加热晶体的方法除去结晶水的原因_____________________________________________________________;
(3)解释Li-SOCl2电池组装必须在无水条件下的原因_______________________________;
(4)工业制硫酸中,SO2的催化氧化采用常压而不是高压的原因______________________;
(5)向NaOH溶液中缓慢通入SO2至过量,反应过程中某微粒X的物质的量浓度随着通入SO2体积的变化如图所示,该微粒X为_____________,SO2过量时溶液仍然存在微粒X的原因____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置制取有机物,下列说法错误的是( )

A.根据温度计读数的不同,可制取乙烯和乙醚
B.b为恒压滴液漏斗,其优点是便于液体顺利滴下
C.将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D.浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com