
 氨在化肥生产、贮氢、燃煤烟气脱硫脱硝等领域用途非常广泛.
氨在化肥生产、贮氢、燃煤烟气脱硫脱硝等领域用途非常广泛.| NH3的质量分数为17%的氨水水 | 无水 NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |
分析 (1)分子式相同结构不同的化合物属于同分异构体;氰酸铵属于盐;
(2)气态转化为液态释放能量;
(3)①化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变;
②达到平衡时ν(正)与ν(逆)相等;
(4)根据SO2+NH3+H2O=NH4HSO3进行计算.
解答 解:(1)氰酸铵(NH4OCN)与尿素[CO(NH2)2]的分子式相同但结构不同,所以属于同分异构体;氰酸铵属于盐,是离子化合物,
故答案为:同分异构体;离子;
(2)气态氨转化为液态氨能量降低,变化过程中释放能量,
故答案为:释放;
(3)①a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,故a错误;
b.该反应是一个反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不随时间的变化而变化,所以能判断反应是否达到平衡状态,故b正确;
c.容器内N2的物质的量分数不再随时间而发生变化说明浓度不在改变,故c正确;
d.物质的量之比不能说明正逆反应速率相等或者浓度不变,故d错误;
故答案为:bc;
②达到平衡时ν(正)与ν(逆)相等,cd点物质的量不再改变,
故答案为:cd;
(4)1000kg×17%=170kg,设无水NH4HSO3的质量为X.
SO2+NH3+H2O=NH4HSO3
17 99
170kg X
解得X=990kg
可获得的利润为990×1.8-1000=782,
故答案为:782.
点评 本题考查化学平衡状态、反应热以及化学方程式的计算等,题目难度中等,注意平衡标志的分析判断.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子体积的大小 | |
| B. | 分子间的间距变了分子间作用力的强弱变了 | |
| C. | 相对分子质量的大小 | |
| D. | 分子内共价键的长短 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,基态f原子的核外电子排布式为1s22s22p63s23p63d104s1.
,基态f原子的核外电子排布式为1s22s22p63s23p63d104s1.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
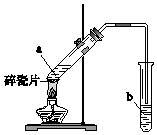 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气发生氧化反应 | |
| B. | 每转移2 mol电子,电池内增加2 mol H20 | |
| C. | 该电池的能量转化率可达100% | |
| D. | 负极附近溶液的pH降坻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/(kJ/mol) | 890.3 | 1299.6 | 285.8 |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | CH4和C2H2中所含化学键完全相同 | |
| C. | 2CH4(g)═C2H2(g)+3H2(g)△H=-376.4kJ/mol | |
| D. | C≡C键能为796.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| B. | 氨基酸为高分子化合物,种类较多,分子中都含有-COOH和-NH2 | |
| C. | 鸡蛋清中加入浓的食盐水可以杀菌消毒,发生了蛋白质变性 | |
| D. | 葡萄糖与银氨溶液或含氢氧化钠的氢氧化铜悬浊液的反应可用于检验葡萄糖的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 油脂和蛋白质在一定条件下都能水解 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com