
| 金属 | 冶炼原理 | |
| A | Fe | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
| B | Hg | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$ 2Hg+O2↑ |
| C | Al | 2AlCl3(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Al+3Cl3↑ |
| D | Na | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ |
| A. | A | B. | B | C. | C | D. | D |
分析 金属的冶炼与金属的活泼性有关,
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:性质不活泼的金属Hg、Ag用加热分解氧化物的方法制得;
物理分离法:Pt、Au用物理分离的方法制得;
据此解答.
解答 解:A.铁性质较不活泼,用热还原法冶炼,故A正确;
B.汞性质稳定,用加热分解氧化物的方法制得,故B正确;
C.氯化铝是分子晶体,通电时不能电离出阴阳离子,所以其熔融态不导电,工业上用电解氧化铝的方法冶炼铝,故C错误;
D.钠为活泼金属,用电解熔融氯化钠的方法冶炼,故D正确;
故选:C.
点评 本题考查了金属的冶炼,明确金属活泼性是解题关键,注意氯化铝的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原电池是利用氧化还原反应将化学能转化成电能的装置 | |
| B. | 金属A与B用导线连接后插入稀硫酸中组成原电池时,A是正极,则B的金属性强于A | |
| C. | 化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 | |
| D. | 对于反应N2(g)+3H2(g)?2NH3(g),单位时间里每增加1molN2,同时增加3molH2,说明反应到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯和苯都能使溴水褪色,褪色的原因不相同 | |
| B. | 天然氨基酸能与强酸或强碱溶液反应 | |
| C. | 豆油、甘油、汽油都属于酯类 | |
| D. | 乙烯、苯、纤维素均属于烃类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,形成的晶体是离子晶体.
,形成的晶体是离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| D. | C2H5OH(水),加足量CaO,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
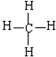
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
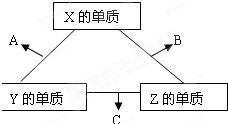
 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 海水密度 | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com