
| A. | I-+BrO3-→IO3-+Br- | |
| B. | 6I-+BrO3-+6H+→3I2+Br-+3H2O | |
| C. | 5I-+6BrO3-+6H+→3Br2+5I03-+3H20 | |
| D. | 5I-+2BrO3-+6H+→Br2+I03-+2I2+3H20 |
分析 根据氧化还原反应中,氧化剂的氧化性强于氧化产物的氧化性规律来分析,如果给出的方程式中氧化性顺序与题干中一致,则反应能够发生,否则反应不能进行.
解答 解:A.I-+BrO3-→IO3-+Br-,氧化大小为:BrO3->IO3-,但是I03->Br2,所以I03-能氧化Br-,则反应产物中不能有Br-,所以该反应不能够发生,故A错误;
B.6I-+BrO3-+6H+→3I2+Br-+3H2O,氧化大小为:BrO3->I2,与题干的氧化性强弱一致,所以该反应能够发生,故B正确;
C.5I-+6BrO3-+6H+→3Br2+5I03-+3H20,氧化大小为:BrO3->IO3-,与题干的氧化性强弱一致,所以该反应能够发生,故C正确;
D.5I-+2BrO3-+6H+→Br2+I03-+2I2+3H20,氧化大小为:BrO3->IO3-,与题干的氧化性强弱一致,所以该反应能够发生,故D正确;
故选A.
点评 本题考查学生氧化还原反应的基本概念及氧化性还原性强弱的判断规律,题目难度中等,把握氧化剂的氧化性强于氧化产物的氧化性即可解答.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴苯(苯):蒸馏 | B. | 苯(苯酚):加溴水振荡后,过滤 | ||
| C. | 乙烷(乙烯):溴水,洗气 | D. | 苯(溴):稀NaOH溶液,分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3 | B. | 1H、2H+ | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | H、D、T |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
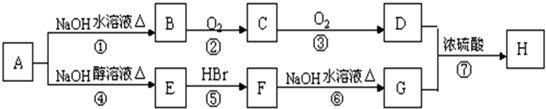
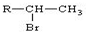 (R为烃基)
(R为烃基)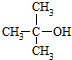 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
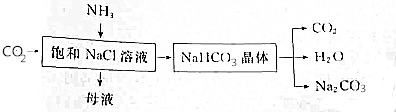
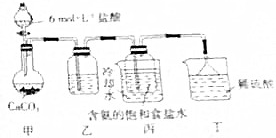
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
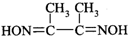 是检验Ni2+的灵敏试剂.
是检验Ni2+的灵敏试剂.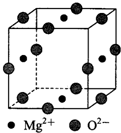
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石硬度很高,用于制作精美首饰 | |
| B. | C60分子可镶入金属钾,用做高温超导体 | |
| C. | 石墨熔沸点高,用做飞船表面隔热材料 | |
| D. | 碳纳米管导电性好,用于制作大规模集成电路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com