
某小组同学查到一份研究过氧化氢溶液与氢碘酸(HI)反应的实验资料,具体如下:
资料1:室温下,过氧化氢溶液可与氢碘酸(HI)反应,溶液为棕黄色。
资料2:实验数据如下表所示。
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| 实验条件 | 保持25℃,101kP条件下 | ||||
| c(H2O2) | 0.1 | 0.1 | 0.1 | 0.3 | 0.3 |
| c(HI) | 0.1 | 0.2 | 0.3 | 0.1 | 0.1 |
| 出现棕黄色时间/s | 13.1 | 6.5 | 4.3 | 4.4 | 4.4 |
(1) 过氧化氢溶液与氢碘酸(HI)反应的化学方程式为 。
(2)①观察资料2中实验编号为1-3数据,分析解释出现棕黄色由慢变快的原因是 。
②该组同学对编号4、5的实验分别升高不同温度,发现升高温度较小的一组,棕黄色出现加快,升高温度较大的一组,棕黄色出现反而变慢,
请你给与分析解释 。
(3)该小组同学欲用碘化钾替代氢碘酸验证上述实验。在实验过程中,未观察到溶液变为棕黄色,却观察到产生无色气体。于是,该小组同学提出假设:KI可能是过氧化氢分
解反应的催化剂(实验室提供KI溶液),并设计如下实验验证其假设。
实验步骤:
I. 取2支试管,向试管1中加入2 mL 0.1 mol/L H2O2溶液,向试管2中加入…….。
II. ……。
III.分别将2支试管置于40℃水浴中。
①补全实验步骤
I: 。
II: 。
②实验现象证明该小组同学假设成立,该实验现象是 。
(4)实验后,该小组同学进一步查阅资料,发现了如下图所示的数据关系,并根
据该数据图提出了如下新假设: 。
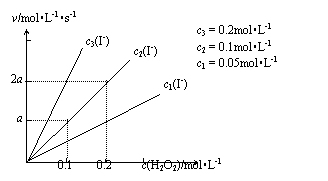 |
(1)H2O2+2HI=2H2O+I2 (2分)
(2)①其他条件不变的情况下,反应物浓度增大,反应速率增加 (2分)
缺:“其他条件不变的情况下”仅得1分。
②温度过高,双氧水分解,反应物浓度降低,造成反应速率减慢 (2分)
(3)① I:2 mL 0.1 mol/L H2O2溶液。(2分)
II:向试管1中加入1mL KI溶液,向试管2中加入1mL水。 (2分)
未写试管2中加入等量的水为0分。
②加入KI溶液的试管中产生气体的速率快。(2分)
(4)反应速率与c(H2O2)和c(I-)成正比 或写:v=kc(H2O2)c(I-) (3分)
若答:催化剂的浓度(或c(I-))会影响化学反应速率 (仅得1分)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
具有下列电子层结构的原子或离子,其对应的元素在周期表中的位置说法正确的是
A.最外层电子排布为1s2的原子和最外层电子排布为2s2的原子,所对应的两元素一定在同一主族
B.3p能级上有1个空轨道的原子和4p能级上有1空轨道的原子,所对应的两元素一定在同一主族
C.最外层电子排布为nsnnpn的原子和最外层电子排布为2s22p6的离子,所对应的两元素一定在同一周期
D.原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子,所对应的两元素一定在同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
大气污染物氟里昂—12的化学式是CF2Cl2。下面关于氟里昂—12的说法正确的是
( )
A.没有固定的熔沸点 B.分子中的碳原子是饱和的
C.属于正四面体的空间结构 D.是乙烷的一种同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
锌片与2mol/L H2SO4反应制取氢气时,下列措施能使氢气生成速率加快的是( )
A.向反应体系中加入5mol/L的硝酸溶液提高氢离子浓度
B.将稀H2SO4改用98%浓H2SO4
C. 向反应体系中立即加入大量CuSO4溶液
D. 向反应体系中加入4.5mol/L的盐酸溶液
D. 反应进行80s时,X物质的量浓度为0.04mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g,该温度下NaOH的溶解度为S。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为______________________________。
(2)用c、d来表示该温度下NaOH的溶解度(S)为_____________________________。
(3)用m、V表示溶液中溶质的物质的量浓度(c)为____________________________。
(4)用w、d表示溶液中溶质的物质的量浓度(c)为_____________________________。
(5)用c、d表示溶液中溶质的质量分数(w)为_________________________________。
(6)用S表示溶液中溶质的质量分数(w)为____________________________________。
(7)用S、d表示溶液中溶质的物质的量浓度(c)为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)使用托盘天平称量药品,都不能直接放在托盘中,应放两张相同的纸片 ( )
(2)定容时,往容量瓶中缓慢加蒸馏水,等液面离容量瓶刻度线1~2 mL时,改用胶头滴管滴加蒸馏水 ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某同学用500 mL容量瓶配制0.10 mol·L-1 NaOH溶液的过程:


该同学的错误步骤有 ( )
A.1处 B.2处 C.3处 D.4处
查看答案和解析>>
科目:高中化学 来源: 题型:
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是( )
A.Z与Y形成的化合物可作为耐高温材料
B.WY2能与碱反应,但不能与任何酸反应
C.原子半径按X、Y、Z、R、W的顺序依次增大
D.熔沸点:X2R>X2Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com