



 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
| A、凡是能提供能量的资源都是能源 |
| B、解决能源危机的有效办法包括提高能源利用率、寻找新能源等 |
| C、化石燃料不可再生、易产生污染,且储量有限,是一种有局限性的能源 |
| D、雾霾中含有大量的PM2.5可吸入颗粒,汽车尾气与雾霾的形成无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
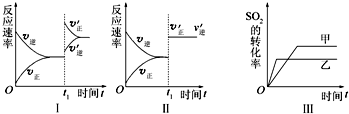
| A、图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
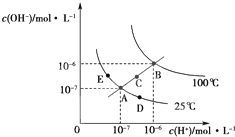
| A、图中五点KW间的关系:B=C=A=D=E |
| B、若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性 |
| C、若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| D、若从A点到D点,可采用:温度不变在水中加入少量的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热、加压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 可逆反应2X+Y?2Z在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示.下列判断正确的是 ( )
可逆反应2X+Y?2Z在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(z)与反应时间(t)的关系如图所示.下列判断正确的是 ( )| A、T1<T2,P1<P2 |
| B、T1<T2,P1>P2 |
| C、T1>T2,P1>P2 |
| D、T1>T2,P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Br-、Cl-、S2- |
| B、Na+、K+、NH4+、Ba2+ |
| C、Ca2+、K+、Cl-、CO32- |
| D、SO32-、NO3-、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2HI(g)═H2(g)+I2(g)△H=+11kJ/mol | ||||
B、
| ||||
| C、H2(g)+I2(g)═2HI(g)△H=+288kJ/mol | ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com