
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下图所示:
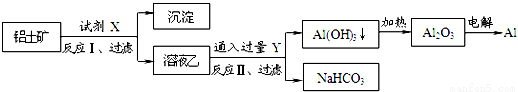
已知:2Na2SiO3+2NaAlO2+2H2O=Na2Al2SiO3↓+4NaOH。对上述流程中的判断正确的是
①试剂X为稀硫酸,沉淀中含有硅的化合物
②反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-
③结合质子(H+)的能力:OH->AlO2->CO32-
④Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
A.①② B.②③ C.①④ D.③④
科目:高中化学 来源:2017届湖南省高三上月考二化学试卷(解析版) 题型:选择题
将过量的SO2通入下列溶液中,都能出现浑浊的组合是
①Ca(OH)2;②BaCl2;③ Na2SiO3;④Ba(NO3)2;⑤苯酚钠;⑥Na2CO3
A.①②③⑥ B.②⑤⑥ C.③④⑤⑥ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期月考二化学试卷(解析版) 题型:填空题
【选修3:物质结构与性质】有A、B、C、D 四种元素,其中 A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p 轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D 的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为 2∶1。请回答下列问题:
(1)A元素形成的晶体内晶胞类型应属于___________(填写“六方” 、 “面心立方” 或“体心立方”)堆积,空间利用率为____________。
(2)C3-的电子排布式为__________,在CB3分子中C元素原子的原子轨道发生杂化,CB3分子的VSEPR模型为_________。
(3)C的氢化物极易溶于水,请解释原因__________________。
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是________________(用元素符号表示);用一个化学方程式说明 B、D两元素形成的单质的氧化性强弱:____________________。
(5)如图所示是R形成的晶体的晶胞,该晶胞与 CaF2晶胞结构相似,设晶体密度是 ρ g·cm-3。R晶体中A+和D2-最短的距离为____________cm。(阿伏加德罗常数用 NA表示,只写出计算式,不用计算)

查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期月考二化学试卷(解析版) 题型:选择题
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于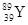 的说法正确的是
的说法正确的是
A. Y在周期表中的位置是第4周期ⅢB族
B. 属于非金属元素
C. 核素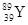 的质子数与中子数之差为50
的质子数与中子数之差为50
D. 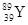 和
和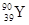 是两种不同的核素
是两种不同的核素
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期月考二化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列判断正确的是
A.在 16g18O2中含有NA个氧原子
B.16gCH4中含有4NA个C-H 键
C.22g 某气体含分子数为 0.5NA,则其摩尔质量为 44
D.含 NA个Na+的Na2O溶解于1L水中, Na+的物质的量浓度为 1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期11月月考化学试卷(解析版) 题型:选择题
某溶液中含有NH4+、Fe2+、Al3+、SO42-、Cl-五种离子,若向其中加入过量的Na2O2,微热并搅拌,再通入过量的HI气体,充分反应后,最后加入足量的硝酸酸化的硝酸钡溶液,则下列叙述不正确的是( )
A.反应后溶液中NH4+、Fe2+、SO42-的物质的量减少,Al3+、Cl-的物质的量不变
B.Fe2+先被氧化并形成沉淀,后来沉淀溶解并被还原为Fe2+,最后又被氧化
C.该实验中共有两种气体生成
D.Al3+先形成沉淀后溶解,后来再形成沉淀接着又沉淀溶解
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三上学期11月月考化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是
A.已知2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol--1,则氢气的燃烧热为241.8kJ/mol
B.已知2C(s)+2O2(g)=2CO2(g)ΔH=akJ·mol-1,2C(s)+O2(g)=2CO(g)ΔH=bkJ·mol-1,则a>b
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-57.3kJ·mol-1,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ
D.已知P(白磷,s)=P(红磷,s)ΔH<0,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江双鸭山一中高三上学期期中化学试卷(解析版) 题型:选择题
科学家开发出一种新型锂—氧电池,其能量密度极高,效率达90%以上。电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:
O2+4LiI+2H2O2I2+4LiOH
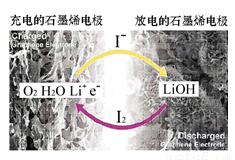
对于该电池的下列说法不正确的是( )
A.放电时负极上I- 被氧化
B.充电时Li+从阳极区移向阴极区
C.充电时阴极反应为LiOH+e-==Li+OH-
D.放电时正极反应为O2+2H2O+4Li++4e-==4LiOH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上期中化学卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol苯乙烯(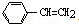 )中含有的C=C数为4NA
)中含有的C=C数为4NA
B.标准状况下,2.24L己烷含有的分子数为0.1NA
C.1mol甲基含10NA个电子
D.某温度下,2.6g乙炔和苯的混合气体中所含碳原子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com