
(6分)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20mL0.01mol/LCH3COOH溶液中逐滴加入0.01mol/L KOH溶液,其pH变化曲线如下图所示(忽略温度变化)。请回答下列有关问题:
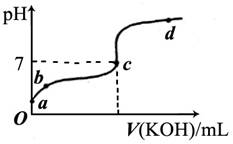
(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度的大小顺序可能有 种情况。
(3)a、b、c三点中水的电离程度最大的是 。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
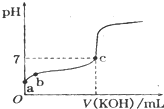 已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.
已知某温度下CH3COOH的电离常数k=1.6×10-5,该温度下向20mL 0.01mol?L-1 CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化),请回答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各溶液的叙述中正确的是( ▲ )
A.0.1mol·L-1的醋酸钠溶液20 mL与0.1mol·L-1盐酸10 mL混合后溶液显酸性
c (CH3COO-)>c (Cl-)>c (CH3COOH)>c (H+)
B.pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+) = c(HSO![]() ) + c(SO
) + c(SO![]() )
)
C.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:
[ c(Na+)-c(F一)] < [ c(K+)-c(CH3COO-) ]
D.已知某温度下Ksp(CH3COOAg) = 2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com