
����Ŀ��ˮ�е��ܽ�����ˮ���������治��ȱ�ٵ�������ij����С����õ������ⶨѧУ�ܱߺ�ˮ�е��ܽ�����ʵ�鲽�輰�ⶨԭ�����£�
��ȡ�������Ĺ̶�
���ܽ���ƿ�ɼ�ˮ������¼����ѹ��ˮ���¶ȣ���ˮ����Mn��OH��2��������Һ������KI����ϣ���Ӧ����MnO��OH��2 �� ʵ�����Ĺ̶���
���ữ���ζ�
�ڵ���ƿ�н��������ˮ���ữ��MnO��OH��2��I����ԭΪMn2+���÷�Ӧ���ȣ����ڰ�������5min��Ȼ���ñ�Na2S2O3��Һ�ζ����ɵ�I2��2S2O ![]() +I2�T2I��+S4O
+I2�T2I��+S4O ![]() ��
��
�ش��������⣺
��1�������Ĺ̶����з�����Ӧ�Ļ�ѧ����ʽΪ ��
��2��ˮ���ữ������Ӧ�����ӷ���ʽ ��
��3���ڵ���ƿ����ͼ���н��з�Ӧ��Ҫ�����������������ϵ�����ˮ����������Ŀ���� �� 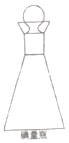
��4��Na2S2O3��Һ���ȶ����ױ������������ܵ�ˮ��CO2�Լ������Ӱ����ֽ⣬���Ƹ���Һʱ��Ҫ������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ���� ��
��5��Na2S2O3��Һ���ȶ���ʹ��ǰ��궨��KIO3������궨Na2S2O3��Һ��Ũ�ȣ���ȡ0.214g KIO3�������KI���ã������ĵ���Na2S2O3��Һ�ζ�����ȥ24.00mL����Na2S2O3��Һ��Ũ��Ϊ����֪M��KIO3��=214.0gmol��1��
��6��ȡ100.00mL ˮ�����������ữ���ø� Na2S2O3��Һ�ζ����Ե�����Һ��ָʾ�����յ�����Ϊ��������Na2S2O3��Һ�����Ϊ10mL����ˮ�����ܽ����ĺ���ΪmgL��1 ��
���𰸡�
��1��2Mn��OH��2+O2=2MnO��OH��2
��2��MnO��OH��2+2I��+4H+=I2+Mn2++3H2O
��3��Һ�⡢��ֹ��ӷ�
��4��ɱ������������������̼
��5��0.25mol/L
��6�������һ�α�Һ����ʱ,��Һ����ɫ��Ϊ��ɫ,�Ұ�������ޱ仯,200
���������⣺��1�������Ĺ̶����з�����Ӧ�Ļ�ѧ����ʽΪ��2Mn��OH��2+O2=2MnO��OH��2��
���Դ��ǣ�2Mn��OH��2+O2=2MnO��OH��2��
��2��ˮ���ữ��MnO��OH��2��������������Һ���������������ɵⵥ�ʣ�������Ӧ�����ӷ���ʽ��MnO��OH��2+2I��+4H+=I2+Mn2++3H2O��
���Դ��ǣ�MnO��OH��2+2I��+4H+=I2+Mn2++3H2O��
��3���ڵ���ƿ����ͼ���н��з�Ӧ��Ҫ�����������������ϵ�����ˮ����������Ŀ���ǣ�Һ�⡢��ֹ��ӷ���
���Դ��ǣ�Һ�⡢��ֹ��ӷ���
��4������ˮ���뾭����С���ȴ�����ʹ�ã���Ŀ����ɱ������������������̼��
���Դ��ǣ�ɱ������������������̼��
��5��Na2S2O3��Һ���ȶ���ʹ��ǰ��궨��KIO3������궨Na2S2O3��Һ��Ũ�ȣ���ȡ0.214g KIO3�������KI���ã�KIO3+5KI+6H+=3I2+3H2O�������ĵ���Na2S2O3��Һ�ζ�����ȥ24.00mL��2S2O32��+I2�T2I��+S4O62����
KIO3��3I2�� | 6S2O32�� |
1 | 6 |
|
|
��Na2S2O3��Һ��Ũ��ΪNa2S2O3Ũ��= 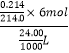 =0.25mol/L��
=0.25mol/L��
���Դ��ǣ�0.25mol/L��
��6��ȡ100.00mL ˮ�����������ữ���ø� Na2S2O3��Һ�ζ����Ե�����Һ��ָʾ�����յ�����Ϊ�����һ�α�Һ����ʱ����Һ����ɫ��Ϊ��ɫ���Ұ�������ޱ仯��2Mn��OH��2+O2=2MnO��OH��2��MnO��OH��2+2I��+4H+=I2+Mn2++3H2O��2S2O32��+I2�T2I��+S4O62����
�õ�
O2��2MnO��OH��2��2I2�� | 4S2O32�� |
1 | 4 |
n | 0.25mol/L��0.01L |
n=0.000625mol��
100mlˮ�����ܽ���������=0.000625mol��32g/mol=0.02g��1Lˮ���ܽ���������0.2g����ˮ�����ܽ����ĺ���Ϊ200mg/L��
���Դ��ǣ������һ�α�Һ����ʱ����Һ����ɫ��Ϊ��ɫ���Ұ�������ޱ仯��200��


 ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������л�����ǣ� ��
A.�軯�أ�KCN��
B.����泥�NH4CNO��
C.��Ȳ��C2H2��
D.̼���裨SiC��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д���������ʵĻ�ѧʽ����������_____����Ư�۵���Ч�ɷ�_____��
��2����ķ�������˵��ӣ������____________ʽ��ԭ�ӽṹģ�����Ӵ��������Ṥ���У����豸_________�з���SO2�Ĵ�������
��3��þȼ�ղ�����CO2����û�ѧ����ʽ��ʾ��������____________________________________��
��4��д��ľ̿��Ũ���Ṳ��ʱ�����Ļ�ѧ��Ӧ����ʽ�� ____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ�������Ӷ�û�������ӵľ����ǣ� ��
A.���Ӿ���
B.��������
C.ԭ�Ӿ���
D.���Ӿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ԭ�������������ƶ�ԭ�ӵ�
�������� �������� �������� ���˵���� �����������
��ԭ�ӽṹʾ��ͼ ��Ԫ�������ڱ��е�λ��
A. �٢ڢۢܢ� B. �٢ܢݢޢ�
C. �ڢۢܢݢ� D. �ۢܢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����Ŀǰȼ��ȼ��ʱ�����Ļ�����Ⱦ��ͬʱ������ԴΣ�����й�ר�����������̫������ȡ���ܵĹ�����ͼ��ʾ������˵����ȷ���ǣ� �� 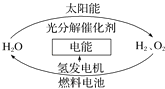
A.����Դ�ѱ��ձ�ʹ��
B.H2O�ķֽⷴӦ�����ȷ�Ӧ
C.����������������䣬�������ü�ֵ
D.2 mol Һ̬H2O���е�����������2 mol H2��1 mol O2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤������ֵ������˵����ȷ���ǣ�������
A.1L0.1mol/L��NaHCO3��Һ��HCO3����CO3 2��������֮��Ϊ0.1NA
B.��״���£�22.4LC2H4��C3H6������������з�����ΪNA
C.1molNa2O2��������CO2��Ӧת�Ƶĵ�����Ϊ2NA
D.18gNH4+�����ĵ�����11NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��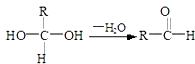
�������ͼ�ش�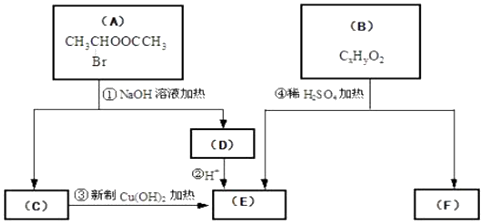
��1��E�к��еĹ����ŵ����������۵ķ�Ӧ������ �� C�����Ƶ�������ͭ��Ӧ�Ļ�ѧ����ʽΪ�� ��
��2����֪B����Է�������Ϊ162����ȼ�ղ�����n��CO2����n��H2O��=2��1����B�ķ���ʽΪ �� F�ķ���ʽΪ ��
��3���ڵ���оƬ�������߷��ӹ�����ǹ��ʴ0.11��m�߿�оƬ�Ĺؼ�������F�����ָ߷��ӹ���������е���Ҫԭ�ϣ�F���������ص㣺���ܸ�FeCl3��Һ������ɫ��Ӧ�����ܷ����Ӿ۷�Ӧ���۷����ϵ�һ�ȴ���ֻ�����֣�F��һ�������·����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ�� ��
��4��������G��F��ͬ���칹�壬�����ڷ����廯����ܷ���������Ӧ��G�������ֽṹ��д����������һ��ͬ���칹��Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com