
下列溶液中各微粒的浓度关系不正确的是( )
|
| A. | 0.1 mol/L CH3COOH溶液中:c(CH3COO﹣)+c(CH3COOH)=0.1mol/L |
|
| B. | NaHCO3溶液中:c(OH﹣)=c(H+)+c(H2CO3)﹣c(CO32﹣) |
|
| C. | CH3COONa溶液中:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+) |
|
| D. | Na2S溶液中:2 c(Na+)=c(S2﹣)+c(HS﹣)+c(H2S) |
考点:
离子浓度大小的比较.
专题:
电离平衡与溶液的pH专题.
分析:
A.根据物料守恒判断;
B.根据物料守恒和电荷守恒判断;
C.根据溶液是酸碱性及电荷守恒判断;
D.根据物料守恒判断.
解答:
解:A.根据物料守恒得c(CH3COO﹣)+c(CH3COOH)=0.1mol/L,故A正确;
B.根据物料守恒得c(Na+)=c(H2CO3)+c(HCO3﹣)+c(CO32﹣),c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣ )+c(OH﹣),所以得c(OH﹣)=c(H+)+c(H2CO3)﹣c(CO32﹣),故B正确;
C.醋酸钠是强碱弱酸盐其溶液呈碱性,所以c(OH﹣)>c(H+),根据电荷守恒得c(Na+)>c(CH3COO﹣),酸根离子浓度大于氢氧根离子浓度,所以c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),故C正确;
D.根据物料守恒得c(Na+)=2c(S2﹣)+2c(HS﹣)+2c(H2S),故D错误;
故选:D.
点评:
本题考查了离子浓度大小的判断,明确物质的性质结合电荷守恒、物料守恒来分析解答即可,难度中等.


科目:高中化学 来源: 题型:
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:
Cd+2NiOOH+2H2O Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
有关该电池的说法不正确的是 ( )
A.放电时化学能不能全部转化为电能
B.放电时Cd为该电池的负极,充电时这一端应接直流电源的正极
C.放电时该电池的正极反应为:NiOOH+H2O+e-===Ni(OH)2+OH-
D.充电时,阴极反应为:Cd(OH)2+2e-===Cd+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为( )
|
| A. | 10% | B. | 20% | C. | 40% | D. | 50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列三个数据:①7.2×10﹣4、②2.6×10﹣4、③4.9×10﹣10分别是三种酸的电离平衡常数,若已知这些酸可以发生如下反应:NaCN+HNO2=HCN+NaNO2 NaCN+HF=HCN+NaF NaNO2+HF=HNO2+NaF 由此可判断下列叙述中正确的是( )
|
| A. | HNO2的电离平衡常数是③ | B. | HNO2的电离平衡常数是① |
|
| C. | HCN的电离平衡常数是② | D. | HF的电离平衡常数是① |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3.
|
| A. | 仅①④ | B. | 仅②④ | C. | 仅①② | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol•L﹣1的一元酸HA与b mol•L﹣1一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
|
| A. | a=b |
|
| B. | 混合溶液的pH=7 |
|
| C. | 混合溶液中,c(H+)= |
|
| D. | 混合溶液中,c(H+)+c(B﹣)=c(OH﹣)+c(A﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
充满HCl的烧瓶做完喷泉实验后得到的稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在 式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从 色变为 色.
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第 种.
①2.500mol•L﹣1 ②0.25mol•L﹣1③0.025mol•L﹣1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验次数编号 | 待 待测盐酸体积(mL) | 滴入Na2CO3 溶液体积(mL) |
| 1 | 20.00 | 19.80 |
| 2 | 20.00 | 16.95 |
| 3 | 20.00 | 17.05 |
求这种待测稀盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原滴定实验与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。现用0.001 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色NaHSO3溶液。反应离子方程式是2MnO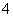 +5HSO
+5HSO +H+===2Mn2++5SO
+H+===2Mn2++5SO +3H2O
+3H2O
填空完成问题:
(1)该滴定实验所需仪器有下列中的____________。
A.酸式滴定管(50 mL) B.碱式滴定管(50 mL)
C.量筒(10 mL) D.锥形瓶 E.铁架台 F.滴定管夹
G.烧杯 H.白纸 I.胶头滴管 J.漏斗
(2)不能用______(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因__________
_________________________________________________________________。
(3)选何种指示剂,说明理由_________________________________________。
(4)滴定前平视KMnO4溶液液面,刻度为a mL,滴定后俯视液面刻度为b mL,则(b-a)mL比实际消耗KMnO4溶液体积________(填“多”或“少”)。根据(b-a)mL计算得到的待测浓度,比实际浓度________(填“大”或“小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com