
| 实验步骤 | 实验现象 |
| a.取少量该溶液,加几滴甲基橙 | 溶液变红色 |
| b.取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气可以变成红棕色 |
| c.取少量该溶液,加BaCl2溶液 | 有白色沉淀生成 |
| d.取少量该溶液,加AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于HNO3 |
| e.取少量该溶液,加NaOH溶液 | 有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
分析 因是无色透明溶液,则不含有Fe2+,由(1)知溶液显酸性,则不存在HCO3-;由(2)知有NO生成,原溶液中含NO3-,则一定不含Fe2+、I-(具有还原性);由(3)知有SO42-存在,则原溶液不含Ba2+;由(4)可知溶液含Cl-,由⑤知含Mg2+、Al3+,以此解答该题.
解答 解:(1)由以上分析可知溶液中一定存在的离子是:NO3-、SO42- Mg2+、Al3+,溶液中肯定不存在的离子是:I-、Ba2+、Fe2+、HCO3-,不能确定的有:K+、Cl-,
故答案为:NO3-、SO42-、Mg2+、Al3+、Cl-;I-、Ba2+、Fe2+、HCO3-;K+;
(2)溶液中存在硝酸盐,在酸性条件下具有强氧化性,可与铜发生氧化还原反应,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,侧重考查常见离子的检验和鉴别,是高考中的常见题型,综合性强,有利于培养学生的逻辑推理能力和实验设计能力,掌握元素化合物性质是关键,注意掌握常见离子的检验,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 直径为1.3×10-9m 的“钴酞菁”分子分散在水中能形成胶体,则该分子的直径比Na+大 | |
| B. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 明矾净水利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
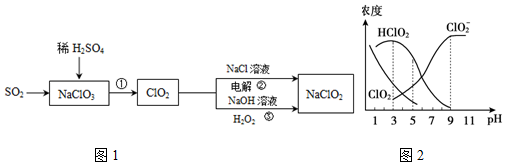
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可以消毒杀菌常用于净水 | |
| B. | 氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 | |
| C. | 氢氧化铝在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子中两个氢原子被氯原子取代后,有两种不同结构分子 | |
| B. | 甲醛能使蛋白质变性,可用于食品防腐剂 | |
| C. | 甲醇分子与水分子之间存在氢键,使甲醇的水溶性显著增强 | |
| D. | 甲苯与苯互为同系物,均能使KMnO4酸性溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、Cl-、NO3-、S2- | B. | K+、Fe2+、I-、SO42- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
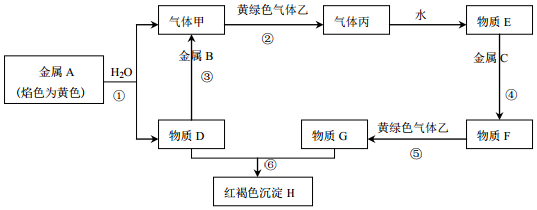
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com