
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 操 作 | 现 象 |
I |
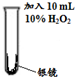 |
剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;反应停止后,试管内壁上的银全部溶解,得到澄清液体a. |
| 实验编号 | 操 作 | 现 象 |
Ⅱ |
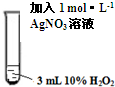 |
振荡,溶液无明显现象. |
Ⅲ |
 |
剧烈反应,产生大量无色气体,同时在试管底部仍有少量黑色固体. |
| 实验步骤和操作 | 实验现象及结论 |
| 取3mL 10% H2O2在试管中,加入少量Ag2O,充分反应后, |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔融态不导电 |
| B、水溶液呈中性 |
| C、熔点比BeBr2高 |
| D、不与NaOH溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com