


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、Ca(OH)2与NH4Cl的反应 |
| B、点燃的镁条在二氧化碳中继续燃烧 |
| C、灼热的碳与二氧化碳的反应 |
| D、酸碱中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
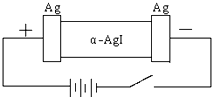 某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4
某同学查资料得知α-AgI是一种固体导体,导电率很高.他为了研究α-AgI究竟是Ag+离子导电还是I-离子导电,设计一个如图所示(用铅蓄电池做电源)的电化学实验.已知铅蓄电池总反应:Pb+PbO2+2H2SO4 | 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | A | B |
| 反应物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH(g)和1molH2O(g) |
| CH3OH(g)浓度(mol?L-1) | c1 | c2 |
| 反应能量变化 | 放出29.4kJ | 吸收akJ |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
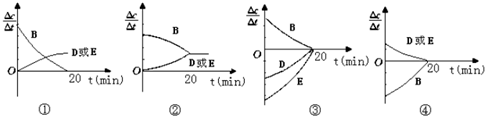

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com