
 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题:
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性,回答下列问题: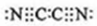 ,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O,故答案为:
,根据氯气和氢氧化钠溶液反应知,(CN)2和NaOH反应生成NaCN、NaOCN、H2O,反应方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O,故答案为: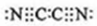 ;2NaOH+(CN)2=NaCN+NaOCN+H2O.
;2NaOH+(CN)2=NaCN+NaOCN+H2O.


科目:高中化学 来源: 题型:
| A、碱性氧化物均为金属氧化物 |
| B、SO2、SiO2、CO均为酸性氧化物 |
| C、烧碱、冰醋酸、四氯化碳均为电解质 |
| D、硫酸、KAl(SO4)2﹒12H2O属于混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸a的浓度可能大于b |
| B、酸a的浓度可能等于b |
| C、酸a的酸性比醋酸弱 |
| D、酸a可能是强酸可能是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
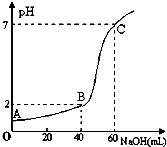 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )| A、所用HCl的浓度是0.09mol?L-1,NaOH溶液浓度为0.03mol?L-1 |
| B、在B点,溶液中离子浓度关系为:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、A、B、C三点水的电离程度大小依次为:A>B>C |
| D、滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
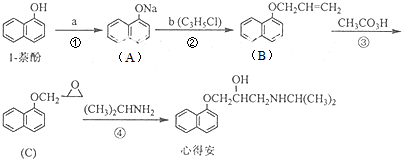
| 反应1 |
| 反应2 |
| 反应3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
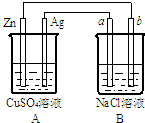 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=| c(CO2) |
| c(CO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com