
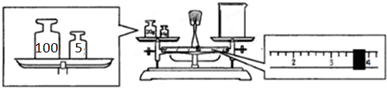
分析 I.(1)利用Na2CO3的物质的量和Na2CO3•10H2O的物质的量相等计算;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,据此计算.
II.(3)实验室无90ml容量瓶,须按100ml容量瓶计算;
(4)根据配制溶液的实验操作过程选择所用仪器;
(5)A.仰视读数体积偏大;
B.量筒无须洗涤,洗涤后导致硫酸的物质的量偏大;
C.有溶液溅到桌面上,导致溶液中溶质的物质的量偏小;
D.定容摇匀后,无须再加蒸馏水;
E.容量瓶不干燥,无影响;
(6)根据n=cV计算出硫酸的物质的量,再计算出含有氢离子的物质的量,从而可知消耗氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算出消耗氢氧化钠溶液的体积;根据c=$\frac{n}{V}$计算出钠离子的浓度.
解答 解:I.(1)实验室配制50g 质量分数为21.2%的Na2CO3溶液,需要Na2CO3的质量为:50×21.2%=10.6克,Na2CO3的物质的量为0.1mol,Na2CO3的物质的量和Na2CO3•10H2O的物质的量相等,Na2CO3•10H2O的物质的量为0.1mol,Na2CO3•10H2O的质量为:0.1mol×286g/mol=28.6g,
故答案为:28.6;
(2)天平平衡原理为左盘内质量=右盘内质量+游码数值,所以实际称得碳酸钠晶体的质量为:25g-3.6g=21.4g,
故答案为:砝码和物品位置颠倒;21.4;
II.(3)实验室无90ml容量瓶,须按100ml容量瓶计算,根据C浓×V浓=C稀×V稀,2.5mol/L×0.1L=$\frac{VmL×1.84g/c{m}^{3}×98%}{98g/mol}$,V=13.6mL,
故答案为:13.6;
(4)配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,一般量筒量取浓硫酸,把浓硫酸倒入烧杯进行溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,配成100mL溶液,所以需要的仪器有玻璃棒、天平、药匙、烧杯、胶头滴管、100mL容量瓶,所以还需要天平、胶头滴管、100mL容量瓶,
故答案为:天平、胶头滴管、100mL容量瓶;
(5)A.用量筒量取浓硫酸时仰视.用量筒量取液体时,仰视读数,使所读液体的体积偏大,使配制的溶液浓度偏高,故A正确;
B.量取浓H2SO4后的量筒进行洗涤,并将洗涤液转移到容量瓶中,量筒在设计时就考虑了不洗涤带来的误差,所以洗涤量筒只能使配制的浓度偏大,故B正确;
C.稀释硫酸时,有溶液溅到桌面上,导致配制的溶液中溶质的物质的量偏低,溶液浓度偏小,故C错误;
D.定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至凹液面最低处与刻度线相切,定容、摇匀、静置后发现凹面低于刻度线又加水至刻度线,溶液的体积偏大,浓度偏小,故D错误;
E.容量瓶不干燥.容量瓶洗涤后内壁有水珠而未作干燥处理,溶液的体积不变,浓度不变,故E错误;
故答案为:BC;
(6)40mL 2.5mol/L的稀硫酸中含有氢离子的物质的量为:2.5mol/L×2×0.04L=0.2mol,发生中和反应需要消耗0.2molNaOH,消耗5mol/L的氢氧化钠溶液的体积为:$\frac{0.2mol}{5mol/L}$=0.04L=40mL;
混合液体积为40mL+40mL=80mL=0.08L,混合液中含有钠离子的物质的量为0.2mol,则反应后钠离子浓度为:$\frac{0.2mol}{0.08L}$=2.5mo/L,
故答案为:40;2.5mol∕L.
点评 本题考查了一定物质的量浓度溶液的配制方法,题目难度中等,明确配制一定物质的量浓度的溶液方法为解答关键,注意掌握误差分析的方法与技巧,试题培养了学生的学生的化学实验能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②2H2(g)+CO2(g)?H2O+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
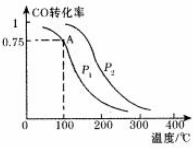 CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
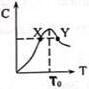 将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:
将物质的量均为3.00mol物质A、B混合于L容器中,发生如下反应3A+B?2C,再反应过程中C的物质的量分数随温度变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) CO2转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | X | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 6MgO+4Al$\frac{\underline{\;\;△\;\;}}{\;}$6Mg+2Al2O3 | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 4.0×10-38 | 2.0×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com