
 2SO3,已知2min后,容器中剩余2mol SO2和12mol O2,则:
2SO3,已知2min后,容器中剩余2mol SO2和12mol O2,则:| △c |
| △t |
 2SO3
2SO3| 6mol |
| 10L |
| ||
| 2min |


科目:高中化学 来源: 题型:
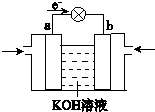 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q是周期表中原子半径最小的元素,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.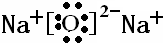
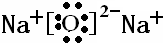
查看答案和解析>>
科目:高中化学 来源: 题型:
 试运用所学知识,解决下列问题:
试运用所学知识,解决下列问题: H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
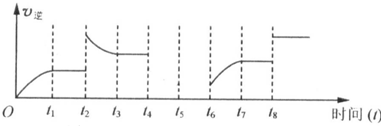
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
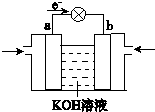
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南省邵阳市洞口县高三(上)第二次月考化学试卷(解析版) 题型:填空题
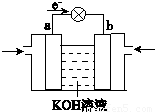
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com