
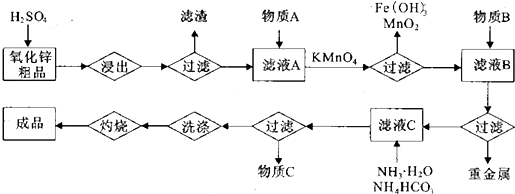
| 金属离子 | 开始沉淀时溶液pH | 完全沉淀时溶液pH |
| Zn2+ | 5.4 | 6.4 |
| Fe2+ | 6.5 | 7.5 |
| Cu2+ | 4.2 | 6.7 |
| Co2+ | 6.6 | 7.6 |
| 0.5mol |
| 3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol?L-1 HNO3、2.00mol?L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol?L-1 HNO3、2.00mol?L-1HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol?L-1 |
| ① | 常温 | 粗颗粒 | 2.00 |
| ② | 常温 | 1.00 | |
| ③ | 粗颗粒 | 2.00 | |
| ④ | 2.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是( )| A、△H>0 a+b>c |
| B、△H<0 a+b<c |
| C、△H<0 a+b>c |
| D、△H>0 a+b<c |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纤维素、涤纶 |
| B、麦芽糖、胰岛素 |
| C、有机玻璃、酚醛树脂 |
| D、淀粉、硫化橡胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
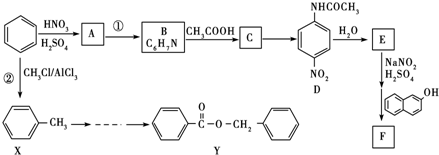

查看答案和解析>>
科目:高中化学 来源: 题型:
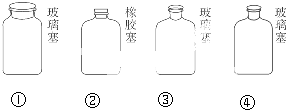
| A、①②③④ | B、②①④③ |
| C、②③④① | D、②①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com