
科目:高中化学 来源: 题型:选择题
| A. | 凡含有食品添加剂的食物对人体健康均有害 | |
| B. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 | |
| C. | 施肥时,农家肥草木灰(有效成分K2CO3)不能与氮肥NH4Cl混合使用 | |
| D. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料. |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障. |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂. |
| D | 室温下其单质呈粉末固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
| E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑦⑧⑨ | B. | ②④⑦⑨ | C. | ③④⑦ | D. | ④⑤⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中加入少许食醋可以增强其漂白效果 | |
| B. | 用二氧化硫漂白米粉是违法行为,因为二氧化硫有毒 | |
| C. | 铝制品在生活中非常普遍,这是因为铝不活泼 | |
| D. | 氢氧化铝可用于治疗胃酸过多,但不宜长期服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
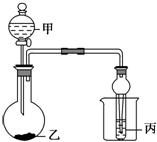 利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )
利用图所示装置进行下列实验,能观察到相应现象并得出相应实验结论的是( )| 选项 | 甲 | 乙 | 丙 | 实验现象 | 实验结论 |
| A | 浓盐酸 | 石灰石 | NaAlO2溶液 | 乙中有无色气泡,丙中先出现沉淀后消失 | 氢氧化铝溶于碳酸 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 乙中蔗糖变黑色、丙中溴水褪色 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 乙中有无色气泡,丙中出现白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 乙中有无色气泡,丙中出现白色沉淀 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2n(C)+n(N)+2 | B. | 2n(C)+2n(N)+n(O) | C. | 3n(C)+2n(O)+2 | D. | 2n(C)+2n(N)+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
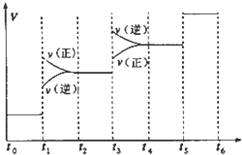 氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
氢气是合成氨的重要原料,合成氨反应的热化方程式如下:| A. | 图中t1时引起平衡移动的条件可能是升高温度 | |
| B. | 表示平衡混合物中NH3的含量最高的一段时间是t5~t6 | |
| C. | 温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为$\frac{16}{{a}_{2}}$ | |
| D. | 在t2~t3时间段,保持容器体积不变,充入一定量的惰性气体,N2的浓度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com