
| ���� | CH3COOH | H2CO3 | HNO2 |
| ���볣����25�棩 | K=1.8��10-5 | K1=4.3��10-7 K2=5.6��10-11 | K=5.0��10-4 |
���� ��1����0.1mol•L-1CH3COOH ��Һ�м�������CH3COONa ����ʱ�������ƴ���ĵ��룬�������Լ����������ڴ����Ƶĵ��룬��Һ��������Ũ������Kwֻ���¶�Ӱ�죬�ݴ˷�����
��2��Na2CO3 ��Һ�е������Ӻ����������Ӷ�����ˮ��������ģ�
��3���������ƽ�ⳣ����֪��HNO2�����Աȴ���ǿ����������Ա�̼��ǿ����ͬ���ʵ���Ũ�ȵĴ����HNO2��ȣ�HNO2��Һ��������Ũ�ȴ�
����ͬ���ʵ���Ũ�ȵĴ�������Ӻ�NO2-��ȣ����������ˮ��̶ȴݴ˷�����
��4���ݴ���ĵ���ƽ�ⳣ��K=$\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$=1.8��10-5��pH=6���㣮
��� �⣺��1����0.1mol•L-1CH3COOH ��Һ�м�������CH3COONa ����ʱ��
a����Һ�����Լ�����pH����a��ȷ��
b�� CH3COOH�ĵ���̶ȼ�С����b����
c����Һ�ĵ���������ǿ����c����
d����Һ��c��OH-����c��H+��=Kw��Kwֻ���¶�Ӱ�죬�¶Ȳ�������Kw���䣬��d��ȷ��
�ʴ�Ϊ��ad��
��2��25��ʱ��0.10mol•L-1Na2CO3 ��Һ��pH=11����c��H+��=10-11mol/L����Kw��֪��c��OH-��=10-3mol/L���ʴ�Ϊ��10-3��
��3���������ƽ�ⳣ����֪��HNO2�����Աȴ���ǿ����������Ա�̼��ǿ����ͬ���ʵ���Ũ�ȵĴ����HNO2��ȣ�HNO2��Һ��������Ũ�ȴ�������̼��������Һ��Ӧ���ʿ죬
�ʴ�Ϊ�������������ƽ�ⳣ����֪��HNO2�����Աȴ���ǿ����������Ա�̼��ǿ����ͬ���ʵ���Ũ�ȵĴ����HNO2��ȣ�HNO2��Һ��������Ũ�ȴ�������̼��������Һ��Ӧ���ʿ죻
�ڳ����£���20mL 0.10mol•L-1CH3COOH��Һ��20mL 0.10mol•L-1HNO2 ��Һ�ֱ���20mL 0.10mol•L-1NaHCO3 ��Һ��ϣ���ַ�Ӧ��õ���ͬ���ʵ���Ũ�ȵĴ����ƺ�����������Һ����ͬ���ʵ���Ũ�ȵĴ�������Ӻ�NO2-��ȣ����������ˮ��̶ȴ����Դ��������Ũ��С���ʴ�Ϊ������
��4������ĵ���ƽ�ⳣ��K=$\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$=1.8��10-5��pH=6����c��H+��=10-6mol/L������K=$\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$=$\frac{1.8��1{0}^{-5}}{1{0}^{-6}}$=18���ʴ�Ϊ��18��
���� ���⿼����������ʵĵ���ƽ�⡢ˮ�����ӻ�������Ӧ�á�������ʵĵ���ƽ�ⳣ����Ӧ�á�����ˮ���е�Խ��Խˮ��ԭ������Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ״̬ | B�� | ���̵� | C�� | �е� | D�� | �ܽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
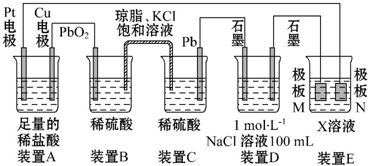
 �ں�����ߺ�DZˮͧ�п��ù���������Ϊ����������ѡ���ʵ��Ļ�ѧ�Լ���ʵ����Ʒ����ͼ�е�ʵ��װ�ý���ʵ�飬֤���������ƿ�����������
�ں�����ߺ�DZˮͧ�п��ù���������Ϊ����������ѡ���ʵ��Ļ�ѧ�Լ���ʵ����Ʒ����ͼ�е�ʵ��װ�ý���ʵ�飬֤���������ƿ�����������| ���� | �����Լ� | ������Լ���Ŀ�� |
| B | ����NaHCO3��Һ | ��ȥCO2�����л����HCl |
| C | ʯ������������� | ��CO2��ˮ����Ӧ������O2 |
| D | NaOH | ����δ��Ӧ��CO2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Һ�м���AgNO3��Һ���ְ�ɫ������ԭ��Һ��һ������Cl- | |
| B�� | ��AgNO3��Һ����Cl-��Br-��I-ʱ��������ϡ��������ữ | |
| C�� | ���������Ƶİ�ˮ��CCl4������Cl-��Br-��I- | |
| D�� | ��ij��ɫ�����м���ϡ���ᣬ����ʹ����ʯ��ˮ����ǵ����壬��ԭ��ɫ����һ��ΪAg2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| 2 | �� | �� | �� | |||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� | �� |
 ��
�� �û������������ӣ�����ۡ������ӡ��������
�û������������ӣ�����ۡ������ӡ���������鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com