
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)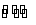 CH3OCH3(g)+3H2O(g) ΔH=122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=122.4kJ·mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中.CH3OCH3(g)的物质的量分数变化如下表所示。
| P1 | P2 | P3 | |
| T1 | 0.10 | 0.04 | 0.02 |
| T2 | 0.20 | 0.16 | 0.05 |
| T3 | 0.40 | 0.35 | 0.20 |
则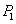 ______
______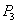 (填“>”“<”或“=”,下同)。若
(填“>”“<”或“=”,下同)。若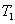 、
、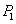 ,
,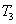 、
、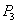 时平衡常数分别为
时平衡常数分别为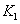 、
、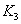 ,则K1_______K3。
,则K1_______K3。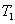 、
、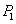 时H2的平衡转化率为________。
时H2的平衡转化率为________。
②一定条件下,上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是________。
a.反应物的浓度降低
b.容器内压强增大
c.正反应速率大于逆反应速率
d.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,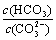 ________(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:_______。
________(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶液呈中性时,下列关系或说法正确的是:_______。
a.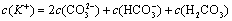
b.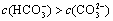
c.降低温度,c(H+)·c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中的每个字母代表一种短周期元素。
下表是元素周期表的一部分,表中的每个字母代表一种短周期元素。
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | a | |||||||
| 2 | b | c | d | |||||
| 3 | e | g | f |
(1)a元素和c元素可以形成的气体,其化学式为 ;
(2)e的元素符号是 ;
(3)b元素原子的最外层电子数为 ;
(4)b、c、d三种元素的非金属性逐渐 (填“减弱”或“增强”);
(5)d元素和f元素均可形成气态氢化物,其稳定性为H2d H2f (填“大于”或“小于”)。
(6)上述七种元素的最高价氧化物的水合物中,碱性最强的是 ,酸性最强的是 ,既有酸性又有碱性的是 (写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合溶液中含有NaI、NaBr、Na2SO4三种溶质,其物质的量均为l mol,向混合溶液中通入一定量的氯气。下列说法正确的是
A.将溶液蒸干最多可以得到4 mol NaCl
B.将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4
C.向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量
D.若通入氯气的体积为11.2 L(标准状况),反应的离子方程式为:2I-+Cl2=I2+2C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
苯的结构式可用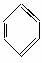 来表示,下列关于苯的叙述正确的是( )
来表示,下列关于苯的叙述正确的是( )
A.苯主要是以煤为原料而获得的一种重要化工原料
B.苯中含有碳碳双键,所以苯属于烯烃
C.苯分子中6个碳碳键完全相同
D.苯可以与溴水、酸性高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g) △H=-90.8 kJ/mol ①
CH3OH(g) △H=-90.8 kJ/mol ①
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol ②
H2(g) +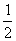 O2(g) = H2O(g) △H=-241.8 kJ/mol ③
O2(g) = H2O(g) △H=-241.8 kJ/mol ③
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g)  CO(g)+2H2O(g)的反应热△H= ▲ kJ/mol。
CO(g)+2H2O(g)的反应热△H= ▲ kJ/mol。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g)  CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
A.CO百分含量保持不变 B.容器中H2浓度与CO浓度相等
C.容器中混合气体的密度保持不变 D.H2的生成速率与CH3OH的生成速率相等
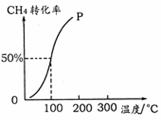 (2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 ( g ) ,测得在一定的压强下CH4的转化率与温度的关系如右图。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 ( g ) ,测得在一定的压强下CH4的转化率与温度的关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为 ▲ 。
②100℃时反应I的平衡常数为 ▲ 。
(3)工业上利用甲醇制备氢气的常用方法有两种:
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g)  CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。

则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为
▲ ;
在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com