
分析 写出各种物质燃烧的热化学方程式,运用盖斯定律求出H2(g)+S(s)?H2S(g)的△H,以此解答该题.
解答 解:已知H2、S、H2S的燃烧热分别是-285.8kJ•mol-1、-297kJ•mol-1、-562.2kJ•mol-1,
则①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 kJ/mol;
②S(s)+O2(g)=SO2(g)△H=-297kJ•mol-1;
③H2S(g)+$\frac{3}{2}$O2(g)=SO2(g)+H2O(l)△H=-562.2kJ•mol-1,
利用盖斯定理,将①+②-③得H2(g)+S(s)?H2S(g)△H=(-285.8kJ•mol-1)+(-297kJ•mol-1)-(-562.2kJ•mol-1)=20.6kJ•mol-1,
故答案为:20.6.
点评 本题考查反应热的计算、盖斯定律的应用,为高频考点,题目难度中等,注意掌握盖斯定律的含义及在反应热计算中的应用,明确热化学方程式的书写原则,试题培养了学生的灵活应用能力.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:选择题
 己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )
己知反应:2Al(l) $\stackrel{催化剂}{?}$B(l)△H=-QkJ/mol,取等量A分别在0℃和20℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示.下列说法正确的是( )| A. | a代表20℃下A的Y-t曲线 | |
| B. | 反应到66min时,0℃和20℃下反应放出的热量相等 | |
| C. | 0℃和20℃下达到平衡时,反应都放出QkJ热量 | |
| D. | 反应都达到平衡后,正反应速率a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
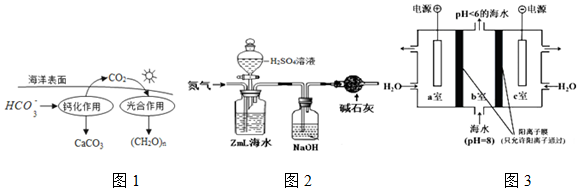
| 测定序号 | NaHCO3溶液的体积/mL | 盐酸标准液滴定管中的读数/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 1.50 | 21.52 |
| 2 | 20.00 | 1.80 | 25.62 |
| 3 | 20.00 | 0.20 | 20.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
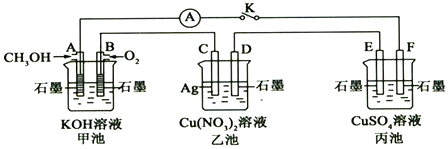
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | 2NaHCO3═Na2CO3+CO2↑+H2O | D. | CaO+H2O═Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质Na2SO4固体的质量为28.4g. (2)称量:用托盘天平称取所需Na2SO4固体. (3)溶解:将称好的Na2SO4固体放入烧杯中,用适量蒸馏水溶解. (4)转移、洗涤:将烧杯中的溶液冷却至室温并注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中. (5)定容:将蒸馏水注入仪器至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (1)实验步骤(3)、(4)中都要用到玻璃棒,其作用分别是搅拌、引流 (2)某同学在实验步骤(6)后,发现凹液面低于刻度线,该同学所配置溶液是浓度=(填“>”、“=”或“<”)0.4mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.5mol/L的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5NA | |
| B. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| C. | 室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | |
| D. | ag某气体含分子数为b,c g该气体在标况下的体积为$\frac{22.4ab}{c{N}_{A}}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8gH2O与CH2D2的混合物中所含质子数为NA | |
| B. | 1mol甲烷或白磷(P4)分子中所含共价键数均为4NA | |
| C. | 1mol CH3COOC2H5在稀硫酸溶液中水解可得到乙醇分子数为NA | |
| D. | 25℃时,l L pH=1的H2SO4溶液中含有的H+ 数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com