
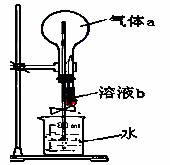
如右图所示,在干燥的圆底烧瓶中充满某气体a,胶头滴管中吸有少量液体b,当把溶液b挤进烧瓶后,打开止水夹不能形成“喷泉”的组合是( )
| 干燥气体a | 液体b | |
| A | NH3 | 水 |
| B | HCl | 水 |
| C | CO2 | NaOH溶液 |
| D | Cl2 | 饱和食盐水 |
科目:高中化学 来源: 题型:
短周期元素X、Y的原子序数相差7,下列有关判断错误的是( )
A.X和Y可能处于同一周期
B.X和Y可能处于相邻周期
C.X和Y可能处于同一主族
D.X和Y可能处于相邻主族
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 |
| 沉淀物 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 8.0 | -0.42 | 2.5 | 7 | 7 |
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有8 g Na2O2、Na2O、Na2CO3、NaOH的混合物与200 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为( )
A.8 g B.15.5 g
C.11.7 g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中保存下列药品的方法,正确的是 ( )
A.氢氟酸可以用玻璃试剂瓶保存
B.浓硫酸盛放在广口瓶中
C.在同一层药品橱里存入浓氨水和浓盐酸
D.盛放硅酸钠水溶液的试剂瓶应用橡皮塞
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合气体中可能含有Cl2 、O2 、SO2 、NO 、NO2 中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是 ( )
A.肯定有SO2 和NO B.肯定有Cl2 、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)?
(2)溶液稀释后,c(H+)是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,下列操作会造成测定结果偏高的原因是:
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修2 化学与技术】(15分)
(15分) 高富氧底吹熔池炼铜新工艺反应炉如图
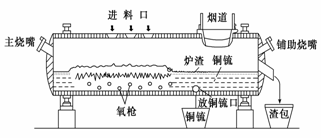
(1)该新工艺的优点之一是混合矿料不需要干燥、磨细。烟气进入余热锅炉后,经静电除尘后进入酸厂回收利用,这样做体现化学的________思想。
(2)该新工艺的优点之二是首次投料需要添加少量的燃料,当反应充分启动后就不需要再投放燃料,说明反应炉中的反应总体来说是________反应。
(3)此法冶炼的矿石主要是黄铜矿(主要成分是CuFeS2),经过上面设备煅烧后最终化合态的铜生成铜和SO2,在冶炼铜矿过程中存在重要反应:2CuFeS2+O2=Cu2S+2FeS+SO2、2Cu2S+3O2=2Cu2O+2SO2、________________________________。
(4)从放铜锍口放出的铜锍中还含有铁和硫必须除去,铜锍吹炼过程是火法冶炼生产粗铜的最后一道工序,吹炼过程分为两个阶段。第一阶段的任务是使铁氧化造渣,主要化学反应为:①2FeS+3O2+SiO2=2FeO·SiO2+2SO2 ,第二阶段是使上一个阶段中没有反应彻底的Cu2S氧化成粗铜,主要化学反应为:②Cu2S+O2=2Cu+SO2,下列关于反应①、②的分析正确的是________(填序号)
A.反应②氧化剂只有O2
B.硫元素在①和②均被氧化
C.①和②在反应过程中都有共价键破坏和共价键形成
(5)图中渣包中的炉渣含有Fe2O3、FeO 、SiO2等,选用提供的试剂设计实验验证炉渣中含有FeO。提供的试剂:KMnO4溶液、KSCN溶液、NaOH溶液、稀硫酸、稀盐酸,所选试剂为_______________。实验现象是__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com