
 有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心.请回答下列问题.
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心.请回答下列问题.分析 A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,则A是H元素;
B是电负性最大的元素,则B是F元素;
C的2p轨道中有三个未成对的单电子,则C是N元素;
F原子核外电子数是B与C核外电子数之和,则F原子核外电子数为16,为S元素;
E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E是Cu元素,D是主族元素且与E同周期,则D位于第四周期;
D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心,晶胞中D离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氟离子个数是8,所以氟离子和D离子个数之比为8:4=2:1,所以D离子带两个单位正电荷,为Ca2+,所以D是Ca元素;
(1)E是Cu元素,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;Cu为面心立方最密堆积;Cu基态中Cu原子配位数=3×8÷2;
(2)H2S分子中S原子价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论判断S原子的杂化类型,S的氧化物SO3分子中S原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断三氧化硫分子空间构型;
(3)NH3极易溶于水,分子间氢键增大物质的溶解性;
(4)D跟B形成的离子化合物的化学式为CaF2;该离子化合物晶体的密度为ag•cm-3,该晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{ρ}$.
解答 解:A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,则A是H元素;
B是电负性最大的元素,则B是F元素;
C的2p轨道中有三个未成对的单电子,则C是N元素;
F原子核外电子数是B与C核外电子数之和,则F原子核外电子数为16,为S元素;
E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E是Cu元素,D是主族元素且与E同周期,则D位于第四周期;
D与B可形成离子化合物其晶胞结构如右图所示,B离子均在晶胞体内,D的离子分占在晶胞顶点和面心,晶胞中D离子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,氟离子个数是8,所以氟离子和D离子个数之比为8:4=2:1,所以D离子带两个单位正电荷,为Ca2+,所以D是Ca元素;
(1)E是Cu元素,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d104s1;Cu为面心立方最密堆积;Cu基态中Cu原子配位数=3×8÷2=12,
故答案为:1s22s22p63s23p63d104s1;面心立方最密堆积;12;
(2)H2S分子中S原子价层电子对个数是4且含有2个孤电子对,根据价层电子对互斥理论知S原子的杂化类型为sp3,S的氧化物SO3分子中S原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知三氧化硫分子空间构型为平面三角形,故答案为:sp3;平面三角形;
(3)氨水中氨气分子和水分子之间形成氢键,氢键导致氢化物的溶解性增强,且二者都是极性分子,所以氨气极易溶于水,
故答案为:氨气与水分子之间形成氢键,且二者都是极性分子;
(4)D跟B形成的离子化合物的化学式为CaF2;该离子化合物晶体的密度为ag•cm-3,该晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{ρ}$=$\frac{\frac{78}{{N}_{A}}×4}{a}$cm-3=$\frac{312}{a{N}_{A}}$cm-3,
故答案为:CaF2;$\frac{312}{a{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断、原子核外电子排布等知识点,利用价层电子对互斥理论、构造原理等知识即可解答,难点是晶胞计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 充电时,阴极反应式:LiCo2-xe-═Li1-xCoO2+xLi+ | |
| B. | 充电时,阳极反应式:6C+xLi++xe-═LixC6 | |
| C. | 充电时,电池的负极与电源的负极相连 | |
| D. | 放电时,Li+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

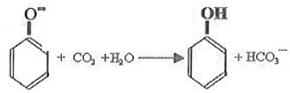

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
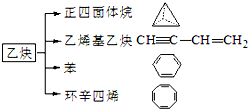 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: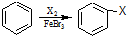 ).
). .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向浓度均为0.1 mol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) | |
| B. | 在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 | |
| C. | 用激光笔分别照射蛋清溶液和葡萄糖溶液,能产生光亮“通路”的是蛋清溶液 | |
| D. | 用铂丝蘸取某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年5月31日是第28个世界无烟日.烟草中的尼古丁是一种有毒物质,其结构如图所示,该物质属于( )
2015年5月31日是第28个世界无烟日.烟草中的尼古丁是一种有毒物质,其结构如图所示,该物质属于( )| A. | 烷烃 | B. | 醇类 | C. | 无机物 | D. | 有机物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com