
一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g)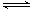 2N2O5(g);已知该反应的平衡常数:
2N2O5(g);已知该反应的平衡常数: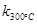 >
>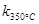 ,且体系中
,且体系中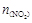 (单位:mol)随时间变化如下表:
(单位:mol)随时间变化如下表:
|
时间(s) |
0 |
500 |
1000 |
1500 |
|
t1℃ |
20 |
13.96 |
10.08 |
10.08 |
|
t2℃ |
20 |
a |
b |
c |
下列说法一定正确的是( )
A.正反应为吸热反应
B.如果t2℃<t1℃,那么 a>b=c,且a=10+0.5b
C.如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D.如果t2℃>t1℃,那么b>10.08
D
【解析】
试题分析:A.由于该反应的平衡常数K300°> K350°,说明升高温度化学平衡向逆反应方向移动。根据平衡移动原理:升高温度化学平衡向吸热反应方向移动,逆反应方向是吸热反应。所以正反应是放热反应。错误。B. 如果t2℃<t1℃,降低温度,化学反应速率减慢,化学平衡向放热方向移动。a>b>c.错误。C.如果t2℃<t1℃,降低温度化学反应速率降低。假如化学平衡不移动t2℃达到平衡的时间大于1000s但平衡逆向移动反应时间又有所缩短。故达到平衡需要的时间无法确定。错误。D.如果t2℃>t1℃,升高温度,化学反应速率加快,化学平衡逆向移动,平衡时NO2的含量增多。故b>10.08。正确。
考点:考查外界条件对化学平衡及反应混合物中各组分的含量影响的知识。


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:
一定温度下,l mol X和n mol Y在体积为2L的密 闭容器中发生如下反应:( )
X(g)+Y(g)![]() 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
A.用X表示此反应的反应速率是(0.1—0.2a)mol·(L·min)-1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入l mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入l mol X,v(正)增大,v(逆)减小,平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com