
(15分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)单质铁属于______晶体,将FeCl3溶液加热蒸干,灼烧所得的物质是______ (填化学式):
(2)请写出铝与氢氧化钠溶液反应的化学方程式______________________________
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,在该深蓝色的浓溶液中加入乙醇所产生的现象是______,画出呈深蓝色的离子的结构式______.
写出Cu与氨水、双氧水反应的离子方程式:____________________________________.
(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,写出其化学方程式____________.
(1)金属晶体(1分),Fe2O3(2分)[来源:学。科。网Z。X。X。K]
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(3分)
(3)析出深蓝色晶体(1分) 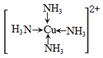 (2分)
(2分)
Cu+4NH3·H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-(3分)
(4)FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O(3分)
解析试题分析:(1)单质铁属于金属晶体,FeCl3溶液存在Fe3+ + 3H2O  Fe(OH)3 + 3H+,加热蒸干促进水解生成氢氧化铁沉淀、灼烧氢氧化铁分解得Fe2O3;(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(3)金属Cu与双氧水发生氧化还原反应,生成的铜离子随即与一水合氨中的氮形成配位键,这种离子化合在乙醇中溶解度小而析出深蓝色晶体,其结构为
Fe(OH)3 + 3H+,加热蒸干促进水解生成氢氧化铁沉淀、灼烧氢氧化铁分解得Fe2O3;(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(3)金属Cu与双氧水发生氧化还原反应,生成的铜离子随即与一水合氨中的氮形成配位键,这种离子化合在乙醇中溶解度小而析出深蓝色晶体,其结构为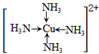 ,离子方程式是Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,同时碳酸氢根离子电离出的氢离子与碳酸氢根离子结合成二氧化碳和水,化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O。
,离子方程式是Cu+4NH3?H2O+H2O2=[Cu(NH3)4]2++4H2O+2OH-;(4)在硫酸亚铁溶液中加入过量的碳酸氢铵,有FeCO3沉淀生成,同时碳酸氢根离子电离出的氢离子与碳酸氢根离子结合成二氧化碳和水,化学方程式为FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O。
考点:考查晶体结构的判断、盐类水解的应用、配位化合物及化学方程式的书写。


科目:高中化学 来源: 题型:单选题
关于晶体的叙述中,正确的是
| A.原子晶体中,共价键的键能越大,熔、沸点越高 |
| B.分子晶体中,分子间的作用力越大,该分子越稳定 |
| C.分子晶体中,共价键的键能越大,熔、沸点越高 |
| D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化学式为AB的离子晶体,已知5r(A2+)=4r(B2-)(各类离子晶体与 关系如下图所示),经测定其密度为
关系如下图所示),经测定其密度为 g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
 cm
cm查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各项中,理由、结论及因果关系均正确的是
| 选项 | 理由 | 结论 |
| A | 键能:N≡N>Cl-Cl | 单质沸点:N2>Cl2 |
| B | 分子中可电离的H+个数:H2SO4>CH3COOH | 酸性:H2SO4>CH3COOH |
| C | 元素的非金属性:N>P | 酸性:HNO3>H3PO4 |
| D | 氧化性:Fe3+>Cu2+ | 还原性:Fe2+>Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6)某离子晶体的晶胞结构如图所示。试求: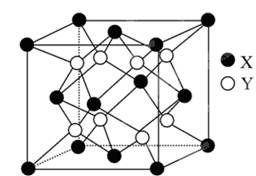
(1)晶体中每一个X同时吸引着________Y,每个Y同时吸引着________个X,该晶体的化学式是________________________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角(∠XYX)为________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的X的核间距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au。其堆积方式为:
(1)简单立方堆积的是____________________________________________;
(2)钾型的是______________________________________________________;
(3)镁型的是______________________________________________________;
(4)铜型的是_____________________________________________________。
Ⅱ.A、B、C、D都是短周期元素,原子半径D>C>A>B,已知:A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。
试回答:
(1)这四种元素分别是:A______,B______,C______,D______(填元素名称)。
(2)这四种元素单质的熔点由高到低的顺序是________(填元素名称)。
(3)C的固态氧化物是________晶体,D的固态单质是________晶体。
(4)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应A+B=C+D的能量变化如右图所示,下列说法正确的是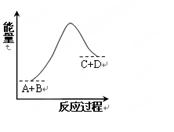
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于能源和作为能源的物质的叙述错误的是
| A.吸热反应的反应物总能量低于生成物总能量 |
| B.绿色植物进行光合作用时,将光能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同条件下转为热能、电能、光能等为人类所利用 |
| D.天然气属于二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
美国LawreceLiremore国家实验室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法中正确的是( )
A.CO2的原子晶体中存在范德华力,每1 mol CO2原子晶体中含有2NAπ键
B.在一定条件下,CO2原子晶体转化为CO2分子晶体是物理变化
C.熔点:金刚石>原子晶体CO2
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com