
【题目】手机芯片是一种在半导体材料上集合多种电子元器件的电路模块。下列可用作半导体材料的是( )
A. 铝 B. 二氧化硅 C. 铁 D. 硅
科目:高中化学 来源: 题型:
【题目】新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图所示。
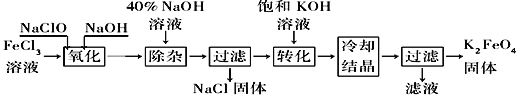
(1)完成“氧化”过程中反应的化学方程式:______FeCl3+______NaOH+______NaClO==______Na2FeO4+______![]() +______
+______![]() 。____________其中氧化剂是________(填化学式)。
。____________其中氧化剂是________(填化学式)。
(2)“转化”过程中发生反应的化学方程式为____________________________________。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是将粗产品用________________溶解,然后________________。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_____________________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________________________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 B. 氯气有漂白性
C. 用排水集气法便可以收集到纯净的氯气 D. 自来水常用氯气来杀菌、消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1mol/L的K2CO3溶液中逐滴加入0.1mol/L的稀盐酸40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是
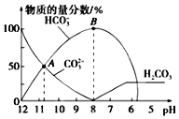
A. 随着稀盐酸的加入,溶液中c(HCO3-)·c(OH-)/c(CO32-)保持不变
B. 根据A点计算,Ka2(H2CO3)的数量级为10-3
C. B点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】-Fe2O3是一种具有磁性、催化等作用的纳米材料,以硫铁矿烧渣等为原料生产制备-Fe2O3的流程如下:
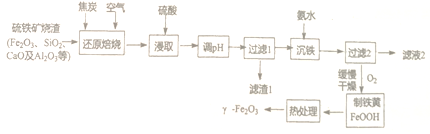
已知:“还原焙烧”的主要反应为:3C+2O2![]() 3CO↑+CO2↑,Fe2O3+CO
3CO↑+CO2↑,Fe2O3+CO![]() 2FeO + CO2
2FeO + CO2
回答下列问题:
(1)“浸取”前需将焙烧生成的混合物粉碎,其目的是_____________________。
(2)“滤渣1”除了CaSO4外还有_______________。
(3)常温下Ksp[Al(OH)3]=1.3×10-33。当常温下溶液pH=6时,c(Al3+)=____________。
(4)“过滤2”时需用蒸馏水洗涤,能证明己洗涤干净的方法是______________;
(5)沉淀缓慢氧化为铁黄的化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为1∶3,则此反应中氧化剂与还原剂的物质的量之比是( )
A.21∶5B.11∶3C.4∶1D.1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①Na2CO3俗称纯碱,其水溶液呈碱性,原因是________________________(用离子方程式解释);
②常温下,0.050 0 mol/L硫酸溶液的pH=__________;
③用0.010 0 mol/L氢氧化钠溶液滴定未知浓度的盐酸,酚酞作指示剂,滴定终点时,溶液的颜色由无色变为__________(填“蓝色”或“浅红色”),且半分钟内保持不变。
(2)①已知H2与O2反应生成1 mol H2O(g)时放出241.8 kJ的热量,请完成该反应的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=__________kJ/mol;
②已知:C(石墨,s)===C(金刚石,s) ΔH>0,则稳定性石墨比金刚石________(填“强”或“弱”)。
(3)在某恒容密闭容器中进行可逆反应FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH>0,平衡常数表达式为K=![]() 。
。
①反应达到平衡后,向容器中通入CO,化学平衡向__________(填“正反应”或“逆反应”)方向移动;
②若降低温度,平衡常数K__________(填“增大”“减小”或“不变”);
③查阅资料得知1 100 ℃时K=0.263。某时刻测得容器中c(CO2)=0.025 mol/L,c(CO)=0.10 mol/L,此时刻反应__________(填“达到”或“未达到”)平衡状态。
(4)电化学是研究化学能与电能相互转化的装置、过程和效率的科学。
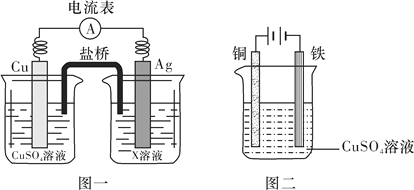
①根据氧化还原反应2Ag+(aq)+Cu(s)===2Ag(s)+Cu2+(aq),设计的原电池如图一所示,X溶液是__________(填“CuSO4”或“AgNO3”)溶液;
②图二装置在铁件上镀铜,铁作阴极,则阴极上的电极反应式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com