
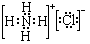 £»¢ŚBČÜÓŚĖ®µÄ¹ż³ĢÖŠ“ęŌŚµÄæÉÄę·“Ó¦Ź½ĪŖNH3+H2O
£»¢ŚBČÜÓŚĖ®µÄ¹ż³ĢÖŠ“ęŌŚµÄæÉÄę·“Ó¦Ź½ĪŖNH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-£®
NH4++OH-£®·ÖĪö £Ø1£©Čō³£ĪĀĻĀX”¢Y”¢Z¾łĪŖĘųĢ壬ÓÉĮ½ÖÖ¶ĢÖÜĘŚŌŖĖŲ×é³ÉĒŅ»ÆŗĻ³É¹ĢĢåŹ±ÓŠ°×ŃĢ²śÉśµÄA”¢BĪŖNH3”¢HClµÄ×éŗĻ£¬AŗĶB»ÆŗĻÉś³É¹ĢĢåCŹ±ÓŠ°×ŃĢ²śÉś£¬øĆĪļÖŹĪŖNH4Cl£¬AµÄĻą¶Ō·Ö×ÓÖŹĮæ“óÓŚB£¬AĪŖHCl£¬BĪŖNH3£¬½įŗĻ×Ŗ»Æ¹ŲĻµæÉÖŖYĪŖH2£¬XĪŖCl2£¬ZĪŖN2£»
£Ø2£©Čō³£ĪĀĻĀYĪŖ¹ĢĢ壬X”¢ZĪŖĘųĢ壬AŌŚæÕĘųÖŠ³ä·ÖČ¼ÉÕæÉÉś³ÉB£¬½įŗĻ×Ŗ»Æ¹ŲĻµæÉĶĘÖŖ£¬YĪŖS”¢XĪŖH2”¢AĪŖH2S”¢BĪŖSO2£®
½ā“š ½ā£ŗ£Ø1£©Čō³£ĪĀĻĀX”¢Y”¢Z¾łĪŖĘųĢ壬ÓÉĮ½ÖÖ¶ĢÖÜĘŚŌŖĖŲ×é³ÉĒŅ»ÆŗĻ³É¹ĢĢåŹ±ÓŠ°×ŃĢ²śÉśµÄA”¢BĪŖNH3”¢HClµÄ×éŗĻ£¬AŗĶB»ÆŗĻÉś³É¹ĢĢåCŹ±ÓŠ°×ŃĢ²śÉś£¬øĆĪļÖŹĪŖNH4Cl£¬AµÄĻą¶Ō·Ö×ÓÖŹĮæ“óÓŚB£¬AĪŖHCl£¬BĪŖNH3£¬½įŗĻ×Ŗ»Æ¹ŲĻµæÉÖŖYĪŖH2£¬XĪŖCl2£¬ZĪŖN2£®
¢ŁCµÄµē×ÓŹ½ŹĒ£ŗ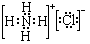 £¬
£¬
¢ŚBČÜÓŚĖ®µÄ¹ż³ĢÖŠ“ęŌŚµÄæÉÄę·“Ó¦Ź½ĪŖ£ŗNH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-£¬
NH4++OH-£¬
¹Ź“š°øĪŖ£ŗ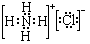 £»NH3+H2O
£»NH3+H2O  NH3•H2O
NH3•H2O  NH4++OH-£»
NH4++OH-£»
£Ø2£©Čō³£ĪĀĻĀYĪŖ¹ĢĢ壬X”¢ZĪŖĘųĢ壬AŌŚæÕĘųÖŠ³ä·ÖČ¼ÉÕæÉÉś³ÉB£¬½įŗĻ×Ŗ»Æ¹ŲĻµæÉĶĘÖŖ£¬YĪŖS”¢XĪŖH2”¢AĪŖH2S”¢BĪŖSO2£®
¢ŁAµÄ»ÆѧŹ½ŹĒH2S£»
¢ŚĻņæĮŠŌÄĘČÜŅŗÖŠĶØČė¹żĮæµÄB£¬Ėł·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒOH-+SO2=HSO3-£»
¢ŪČōAµÄČ¼ÉÕČČĪŖM kJ•mol-1£¬øĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ2H2S£Øg£©+3O2£Øg£©=2SO2£Øg£©+2H2O£Øl£©”÷H=-2MkJ/mol£¬
¹Ź“š°øĪŖ£ŗH2S£»OH-+SO2=HSO3-£»2H2S£Øg£©+3O2£Øg£©=2SO2£Øg£©+2H2O£Øl£©”÷H=-2MkJ/mol£®
µćĘĄ ±¾Ģāæ¼²éĪŽ»śĪļĶʶĻ£¬ŹōÓŚ²Ā²āŃéÖ¤ŠĶĢāÄ棬ŠčŅŖѧɜŹģĮ·ÕĘĪÕŌŖĖŲ»ÆŗĻĪļÖŖŹ¶£¬ÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
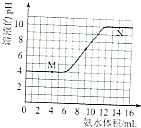 ³£ĪĀĻĀ£¬ÓĆŅ»¶ØÅØ¶ČµÄ°±Ė®µĪ¶ØŅ»¶ØĢå»żĪ“ÖŖÅØ¶ČµÄĶĮČĄ½ž³öČÜŅŗ£¬ČÜŅŗµÄpH±ä»ÆÓėµĪČė°±Ė®Ģå»żµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
³£ĪĀĻĀ£¬ÓĆŅ»¶ØÅØ¶ČµÄ°±Ė®µĪ¶ØŅ»¶ØĢå»żĪ“ÖŖÅØ¶ČµÄĶĮČĄ½ž³öČÜŅŗ£¬ČÜŅŗµÄpH±ä»ÆÓėµĪČė°±Ė®Ģå»żµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | øĆĶĮČĄŹĒĖįŠŌĶĮČĄ | |
| B£® | µ±ČÜŅŗÖŠc£ØH+£©=c£ØOH-£©Ź±£¬ĻūŗÄ°±Ė®µÄĢå»żĪŖ9mL | |
| C£® | M”¢NµćÓÉĖ®µēĄė³öµÄĒāĄė×ÓÅضČŅ»¶ØĻąµČ | |
| D£® | ½«20mL“Ė°±Ė®Óė10mLĶ¬ÅØ¶ČµÄŃĪĖį»ģŗĻ£¬³ä·Ö·“Ó¦ŗó“ęŌŚ£ŗC£ØNH4+£©£¾c£ØCl-£©£¾c£ØNH3•H2O£©£¾c£ØOH-£©£¾c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
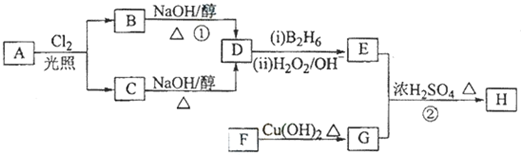
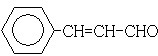 £»
£»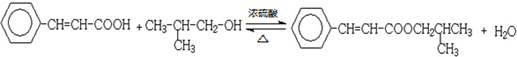 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

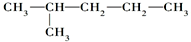 Óė
Óė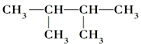
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NaCl”¢NaBr”¢KIČżÖÖĪŽÉ«ČÜŅŗ | |
| B£® | HCl”¢NaCl”¢NaNO3”¢Na2CO3ĖÄÖÖČÜŅŗ | |
| C£® | NaBr”¢KCl”¢HClČżÖÖČÜŅŗ | |
| D£® | µķ·Ū”¢µķ·Ūµā»Æ¼Ų”¢KI”¢äåĖ®ĖÄÖÖČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
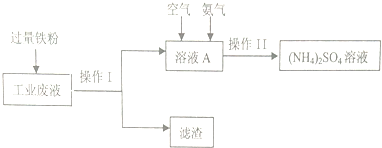
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 3 | B£® | 4 | C£® | 5 | D£® | 6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ±½×ōæØŅņŹĒ¾Ö²æĀé×ķŅ©£¬³£ÓĆÓŚŹÖŹõŗó““ÉĖÖ¹Ķ“”¢Ą£ŃńĶ“µČ£¬Ęä½į¹¹¼ņŹ½£ØČēĶ¼£©£¬ĻĀĮŠ¹ŲÓŚ±½×ōæØŅņµÄŠšŹöÕżČ·µÄŹĒ£Ø””””£©
±½×ōæØŅņŹĒ¾Ö²æĀé×ķŅ©£¬³£ÓĆÓŚŹÖŹõŗó““ÉĖÖ¹Ķ“”¢Ą£ŃńĶ“µČ£¬Ęä½į¹¹¼ņŹ½£ØČēĶ¼£©£¬ĻĀĮŠ¹ŲÓŚ±½×ōæØŅņµÄŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | ·Ö×ÓŹ½ĪŖC9H10NO2 | |
| B£® | ±½»·ÉĻÓŠ2øöČ”“ś»ł£¬ĒŅŗ¬ÓŠĻõ»łµÄ±½×ōæØŅņµÄĶ¬·ÖŅģ¹¹ĢåÓŠ9ÖÖ | |
| C£® | 1 moløĆ»ÆŗĻĪļ×ī¶ąÓė4 molĒāĘų·¢Éś¼Ó³É·“Ó¦ | |
| D£® | ·Ö×ÓÖŠ½«°±»ł×Ŗ»Æ³ÉĻõ»łµÄ·“Ó¦ĪŖŃõ»Æ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com