
 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:分析 为了验证氯元素的非金属性比硫元素的非金属性强,可用A制备氯气,因氯气中含有氯化氢、水蒸气,应先通过饱和食盐水除去氯化氢,B应为硫化钠溶液,与氯气发生氧化还原反应生成硫,溶液变浑浊,可证明氯气的氧化性,C为尾气吸收装置,
(1))从实验室制取氯气的原理:二氧化锰和浓盐酸之间反应来制取分析;
(2)二氧化锰和浓盐酸反应制得的氯气中含有氯化氢杂质,可以用饱和食盐水除去;
(3)证明氯气的氧化性强于硫单质的实验室氯气和硫化钠之间的反应,氧化性越强则原子的得电子能力强;
(4)判断原子的得电子能力强弱的方法:最高价氧化物对应水化物的酸的酸性强弱、离子的还原性强弱、氢化物的稳定性、将同样的金属氧化到的价态等;
(5)元素的非金属性的强弱可以根据元素最高价氧化物对应水化物的酸的酸性强弱、阴离子的还原性强弱、氢化物的稳定性等判断;
(6)判断元素的非金属性的强弱可以根据元素最高价氧化物对应水化物的酸的酸性强弱、阴离子的还原性强弱、氢化物的稳定性等,不能根据在碱性条件下自身的氧化还原判断.
解答 解:(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2,
故答案为:浓盐酸;MnO2;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为: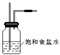 ,故答案为:
,故答案为: ;除去Cl2中的HCl气体;
;除去Cl2中的HCl气体;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓,
故答案为:A;有淡黄色沉淀生成;Na2S+Cl2=2NaCl+S↓;置换;
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强,
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;
(5)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强,
故答案为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强(其他合理答案均可);
(6)判断元素金属性强弱的依据有:最高价氧化物对应水化物的碱性强弱、单质与水或酸反应置换出氢气的剧烈程度、金属之间的置换反应等,而判断元素具有金属的依据与之不同,如(5)所述.因此,Cl元素的化合价既有升高又有降低,不能说明氯元素既具有金属性又具有非金属性,
故答案为:不能,金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断(其他合理答案均可).
点评 本题应从实验装置着眼,从比较Cl和S的非金属性强弱着手,从整体的角度把握题目需要解答的问题,要通过本题建立解答本类题的正确思维过程.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:多选题
| A. | 23gNa变为Na+时失去的电子数为NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 8g He所含的分子数为NA | |
| D. | 16g O2与16g O3所含的原子数均是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1S22S22P63S1→1S22S22P6 | |
| B. | 3S23P5→3S23P6 | |
| C. | 2P${\;}_{x}^{2}$2P${\;}_{y}^{1}$2P${\;}_{z}^{1}$→2P${\;}_{x}^{1}$2P${\;}_{y}^{1}$2P${\;}_{x}^{2}$ | |
| D. | 2H→H-H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 氧化性:Cu2+>Fe3+ |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 溶度积:Ksp(CaCO3)<Ksp(CaSO4) |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 有弱酸性,能与NaHCO3溶液反应 | |
| B. | 在一定条件下,1 mol该物质最多能与7 mol NaOH完全反应 | |
| C. | 在一定条件下,1 mol该物质可以和8 mol H2发生加成反应 | |
| D. | 能发生水解反应,水解后能生成两种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO4-、SO42- | B. | K+、Na+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、NO3- | D. | Ba2+、K+、OH-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com