
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2•6H2O晶体后,仍能大量共存的是( )
A.Na+、H+、Cl-、NO3- B.Na+、Mg2+、Cl-、SO42-
C.K+、Ba2+、OH-、I- D.Cu2+、CO32-、Br-、ClO-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )。
A.含金属元素的离子,不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对化学知识概括合理的是( )
A.酸性氧化物都是非金属氧化物
B.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
C.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
D.熔融状态能导电的物质一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.HClO中氯元素化合价比HClO4中氯元素化合价低,所以,HClO4的氧化性强
B.已知①Fe + Cu2+ = Fe2+ + Cu;② 2Fe3+ + Cu = 2Fe2+ + Cu2+,则氧化性强弱顺序为:Fe3+ > Cu2+ > Fe2+
C.已知还原性:B- > C-> D-,反应 2C- + D2 = 2D- +C2和
反应 2C-+ B2 = 2B- +C2都能发生
D.具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Al3+、
Fe3+、SO42―、CO32―、Cl―和I―。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中最终无沉淀;
(4)取部分上述碱性溶液,通入过量CO2气体有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中:
① 肯定含有的离子是 ;
② 肯定不存在的离子是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的转化,不能通过一步反应实现的是( )
A.S→SO3→H2SO4 B.Al(OH)3→Al2O3→Al
C.Cu→CuCl2→Cu(OH)2 D.Na→Na2O2→Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2
完成下列填空:
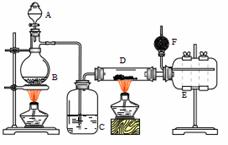
A为浓硫酸,B为NaCl固体
(1)进行实验时应先点燃 (选填“B”或“D”)处酒精灯。
(2)用粗短导管连接D、E的目的是________(选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
(3)F中盛有碱石灰,其目的是 (选填序号)。
a. 吸收多余HCl b. 吸收Cl2 c. 吸收CO2 d. 防止空气中H2O进入E瓶
(4)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是 。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(1)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是 (填序号)。
| a.测定溶液的pH | b.加入Ba(OH)2溶液 | c.加入盐酸 |
| d.加入品红溶液 | e.用蓝色石蕊试纸检测 |
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是________ ______。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:

(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O = H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是
A.A3BC4 B.A2BC4 C.A2BC3 D.ABC4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com