
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
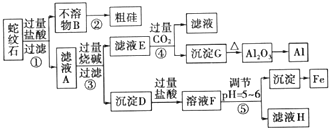
分析 蛇纹石矿加盐酸溶解,发生反应的化学方程式为MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,SiO2不与盐酸反应,以固体形式先除去,因此,不溶物B为SiO2,滤液A中除了Mg2+外,还有的金属离子是Al3+和Fe3+,加入过量烧碱,滤液E为偏铝酸钠溶液,通入过量二氧化碳反应生成氢氧化铝沉淀,加热分解生成氧化铝,用电解法冶炼可生成铝;沉淀D为Fe(OH)3和Mg(OH)2,加入过量盐酸生成氯化铁和氯化铝,调节溶液pH=5~6时,促进铁离子水解,生成氢氧化铁沉淀,滤液H为氯化镁溶液,在HCl氛围中加热、蒸发结晶可得MgCl2•6H2O,脱水生成MgCl2,电解可得Mg.
(1)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成,蛇纹石加过量盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)不溶物为SiO2,二氧化硅和碳反应变成硅,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,碳是还原剂,二氧化硅是氧化剂;滤液A中含有镁离子、铁离子和铝离子、氢离子,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,偏铝酸根离子和二氧化碳能发生反应;
(3)加入的物质能和酸反应且不能引进杂质;
(4)活泼金属采用电解的方法冶炼;
(5)有气泡冒出因2Al+2OH-+2H2O═2AlO2-+3H2↑;因碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解;
解答 解:(1)蛇纹石加过量盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去,所以滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+,
故答案为:Fe3+、Al3+、Mg2+、H+;
(2)由(1)分析可知操作②中不溶物为SiO2,工业上粗硅的生产,用二氧化硅和碳反应,碳是还原剂,二氧化硅是氧化剂,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,反应方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;滤液A中含有镁离子、铁离子和铝离子、氢离子,氢离子和氢氧化钠反应生成水,镁离子、铁离子和铝离子都和氢氧化钠反应生成氢氧化物沉淀,氢氧化镁、氢氧化铁不溶于氢氧化钠溶液中,但氢氧化铝易溶于氢氧化钠溶液中生成偏铝酸根离子,偏铝酸根离子和二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)操作⑤中加入的物质能和盐酸反应,且不引进新的杂质,氧化镁、氢氧化镁难溶于水,但能与酸反应,可起调节pH作用,
故答案为:cd;
(4)镁是活泼金属,应采用电解其熔融盐的方法冶炼,所以工业上用电解熔融氯化镁的方法冶炼镁,反应方程式为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑,
故答案为:电解;
(5)铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;b;
点评 本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| B. | 石墨晶体中只有共价键,不存在其他的作用力 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下用广范pH试纸测得某氯水的pH=4 | |
| B. | 酸式滴定管的润洗操作:关闭滴定管活塞,往上口加入3~5mL待装液,倾斜着转动滴定管,使液体润湿滴定管内壁,然后将液体从上口倒出,重复此操作2~3次 | |
| C. | 若酸碱中和滴定过程中用待测液润洗锥形瓶,则测定结果偏高 | |
| D. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅(半导体材料) | B. | 二氧化硅(制光导纤维) | ||
| C. | Na2Si03 (用作粘合剂,俗称水玻璃) | D. | Al(OH)3(用作胃药,俗称人造刚玉) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2、CaCl2 | B. | CO2、CH4 | C. | NH4Cl、NaOH | D. | NaF、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

实验 记录 | ①Zn质量减少,Cu质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42- 向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e-═Cu |
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH02 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com