
对可逆反应4NH3(g) + 5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H2O)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
A.HCO3- B.Cl- C.Mg2+ D.Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
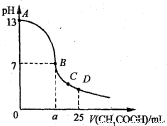
A、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH—)
B、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
C、曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
D、B点的横坐标a=12.5ml
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:填空题
(14分)现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,
若维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。

则0~2 min内的平均反应速率υ(C)= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:选择题
在密闭容器中一定量混合气体发生反应:2A (g) + B (g)) xC(g),达到平衡时测得 A的浓度为 0.5 mol/L,在温度不变的条件下,将容器的容积扩大到原来的2倍, 再达平衡时测得A的浓度为 0.3 mol/L ,下列有关判断正确的是
xC(g),达到平衡时测得 A的浓度为 0.5 mol/L,在温度不变的条件下,将容器的容积扩大到原来的2倍, 再达平衡时测得A的浓度为 0.3 mol/L ,下列有关判断正确的是
A.x = 3 B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:选择题
在1 000 K时,已知反应Ni(s)+H2O(g) NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应
NiO(s)+H2(g)的平衡常数K=0.059,当水蒸气和氢气的物质的量浓度相等时,此反应
A.已达平衡状态 B.未达平衡状态,反应正向进行
C.未达平衡状态,反应逆向进行 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省高二上学期期中考试化学试卷(解析版) 题型:选择题
加热N2O5,依次发生的分解反应为:①N2O5(g) N2O3(g)+O2(g), ②N2O3(g)
N2O3(g)+O2(g), ②N2O3(g) N2O(g)+O2(g).在容积为2L的密闭容器中充入8molN2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为
N2O(g)+O2(g).在容积为2L的密闭容器中充入8molN2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为
A.10.7 B.8.5 C.9.6 D.10.2
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省赣州市北校区高二1月月考化学试卷(解析版) 题型:填空题
(14分) (1)物质的量浓度均为0.1 mol/L的下列溶液:①NH4Cl、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH,pH由大到小的顺为: (填数字代号)
(1)物质的量浓度均为0.1 mol/L的下列溶液:①NH4Cl、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH,pH由大到小的顺为: (填数字代号)
(2)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 _____________________ _____________。
(3)常温下,0.1 mol/L的NaHCO3溶液的pH大于8,则溶液中C(H2CO3)___ _C( CO32-) (填>、=或<),原因_________ ____
(用离子方程式和必要的文字说明)
(4)常温下,pH=a某强酸溶液V1 L,pH=b某强碱溶液V2 L,已知a+b=12,两溶液混合后pH=7,求V1 和V2的关系
(5)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)=____ ____
(6)常温下,已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中的Mg2+浓度
为 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高一12月月考化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.水晶和陶瓷的主要成分都属于硅酸盐
B.单质硅是制造光导纤维的材料
C.硅酸钠是制备硅胶和木材防火剂的原料
D.SiO2是酸性氧化物,它不溶于水也水溶于任何酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com