
【题目】工业上利用氟碳铈矿(主要成分CeCO3F)提取CeCl3的一种工艺流程如下:

请回答下列问题:
(1)已知CeCO3F中C为+4价,Ce元素的化合价为_______。焙烧后Ce元素被________。(填“氧化”或“还原”)
(2)酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染。写出稀硫酸、H2O2与CeO2反应的离子方程式:_______________________________。
(3)向Ce(BF4)3中加入KCl溶液的目的是__________________。
(4)CeCl3 .6H2O属于___________物(填“纯净”或“混合物”)
(5)准确称取0.75gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+,然后加入25ml 0.10mol/l (NH4)2Fe(SO4)2与之恰好反应完。(已知:Fe2++Ce4+=Ce3++Fe3+)该样品中CeCl3的质量分数为____________。
【答案】 +3 氧化 H2O2+2CeO2+6H+===2Ce3++4H2O+O2↑ 避免三价铈以Ce(BF4)3沉淀的形式损失(或除去BF![]() 或提高CeCl3的产率或其他合理答案) 纯净 82.2%
或提高CeCl3的产率或其他合理答案) 纯净 82.2%
【解析】(1). 已知CeCO3F中C为+4价,根据化合价代数和为0可知,Ce元素的化合价为+3价,焙烧后所得的产物为CeO2、CeF4,在这两种物质中Ce元素的化合价都是+4价,所以在焙烧过程中Ce元素的化合价升高,被氧化,故答案是:+3;氧化;
(2). 稀硫酸、H2O2、CeO2反应的离子方程式是:H2O2+2CeO2+6H+===2Ce3++4H2O+O2↑,故答案为:H2O2+2CeO2+6H+===2Ce3++4H2O+O2↑;
(3). 向Ce(BF4)3中加入KCl溶液生成CeCl3和KBF,这样做的目的是避免三价铈以Ce(BF4)3沉淀的形式损失或除去BF4或提高CeCl3的产率,
故答案为:避免三价铈以Ce(BF4)3沉淀的形式损失(或除去BF4或提高CeCl3的产率);
(4).含有固定数目结晶水的化合物都是纯净物,故CeCl3.6H2O属于纯净物。
(5). 25ml 0.10mol/l (NH4)2Fe(SO4)2溶液,含有亚铁离子的物质的量为2.5×103mol,根据反应Fe2++Ce4+=Ce3++Fe3+,利用Ce元素守恒可知,CeCl3的质量为2.5×103mol×246.5g/mol=0.6163g,所以样品中CeCl3的质量分数为0.6163g÷0.75g×100%=82.2%,
故答案为:82.2%。


科目:高中化学 来源: 题型:
【题目】将22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.2molNO2和0.3molNO,下列说法正确的是
A. 反应后生成的盐只有Fe(NO3)3
B. 反应后生成的盐只有Fe(NO3)2
C. 反应后生成的盐为Fe(NO3)2和Fe(NO3)3,其物质的量之比为1:3
D. 反应后生成的盐为Fe(NO3)2和Fe(NO3)3,其物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①Cl2②铝③醋酸(CH3COOH)④CO2⑤H2SO4⑥熔融Ba(OH)2 ⑦氨水⑧稀硝酸⑨Al2(SO4)3固体 ⑩NaHSO4
(1)按物质的分类方法填写表格的空白处:
属于非电解质的是__________;属于弱电解质的是________;属于强电解质的是__________;能导电的是____________。
(2)写出③溶于水时的电离方程式________________________________________。
(3)实验室常用高锰酸钾固体与浓盐酸在常温下反应来快速制备少量①。反应方程式为: KMnO4 + HCl(浓) —— KCl + MnCl2 + Cl2↑ + H2O(未配平)
配平上述反应并用双线桥法标出反应中电子转移的方向和数目:____________________
KMnO4 + HCl(浓) —— KCl + MnCl2 + Cl2↑ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
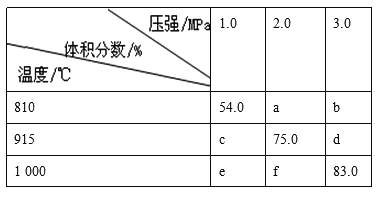
①b<f ②915℃、2.0 MPa时E的转化率为60% ③该反应是△S>0 ④K(1000℃)>K(810℃)
上述①~④中正确的有( )
A. 4个 B. 3个 C. 2个 D. 1个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号中的分离方法运用得当的是
A. 植物油和水(蒸馏)
B. 水溶液中的食盐和碘(分液)
C. CaCO3和CaCl2(溶解、过滤、蒸发)
D. 自来水中的杂质(萃取)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
![]()
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或 C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生进行蔗糖的水解实验,并检验水解产物中是否含有葡萄糖。他的操作如下:取少量纯蔗糖加配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;在冷却后的溶液中加入银氨,在水浴中加热。实验结果没有银镜产生。其原因是( )
A. 蔗糖尚未水解 B. 蔗糖水解的产物中没有葡萄糖
C. 加热时间不够 D. 煮沸后的溶液中没有加碱,以中和作催化剂的酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工厂的废水中含有较多的H+、Cu2+、Fe2+、SO42-、AsO43-、HAsO42-、 H2AsO4-等需要处理的杂质离子,其中一种处理流程如图所示

已知:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)2]=8.6×10-16;H3AsO4为弱酸。
(1)沉淀A的主要成分的化学式是__________________。
(2)常温下pH=7的溶液中Cu2+的物质的量浓度为_______,此时Fe2+是否沉淀完全_______(填“是”或“否”)。
(3)若氧化过程中生成了某种胶体,用离子方程式解释氧化过程中溶液pH降低的原因__________。
(4)最后一次调节pH时pH过低或过高砷的去除率都会明显降低,pH过低时可能的原因是________(从平衡角度解释);pH过高时可能的原因是_________________(从沉淀转化的角度解释)。
(5)硫化法是另一种处理含砷废水的方法,涉及的反应有
Na2S+H2SO4![]() Na2SO4+H2S ①
Na2SO4+H2S ①
2H3AsO3+3H2S![]() As2S3↓+6H2O ②
As2S3↓+6H2O ②
As2S3+H2SO4(浓) ![]() As2O3↓+4S↓+H2O ③
As2O3↓+4S↓+H2O ③
在反应①和③中,硫酸表现出的性质依次是_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对分子式为C3H8O的有机物进行仪器红外光谱显示有对称甲基,羟基等基团;核磁共振氢谱有三个峰,峰面积之比为1:1:6,则该化合物的结构简式为( )
A.CH3OCH2CH3B.CH3CH(OH)CH3C.CH3CH2CH2OHD.C3H7OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com