
分析 (1)①湿法制备高铁酸钾(K2FeO4)时,Fe(OH)3失电子被氧化生成K2FeO4,则C1O-作氧化剂被还原生成C1-,氢氧化铁必须在碱性条件下存在,所以该反应是在碱性条件下进行,再结合转移电子守恒配平方程式;
②至饱和可析出高铁酸钾,与溶解度有关;
(2)该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价,得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,再结合Na2FeO4和转移电子之间的关系式计算.
解答 解:(1)①湿法制备高铁酸钾(K2FeO4)时,Fe(OH)3失电子被氧化生成K2FeO4,则C1O-作氧化剂被还原生成C1-,氢氧化铁必须在碱性条件下存在,所以该反应是在碱性条件下进行,该离子反应为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O;
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明相同条件下高铁酸钾的溶解度比高铁酸钠的溶解度小,
故答案为:相同条件下高铁酸钾的溶解度比高铁酸钠的溶解度小;
(2)该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价,
①得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以Na2O2是氧化剂、Na2O2、FeSO4是还原剂,根据Na2FeO4和转移电子之间的关系式知,每生成l mol Na2FeO4转移电子的物质的量为5mol,
故答案为:Na2O2;Na2O2、FeSO4;5;
②K2FeO4中Fe元素的化合价为+6价,具有强氧化性,且还原产物铁离子能水解氢氧化铁胶体,胶体具有吸附性能吸附除去水中的悬浮杂质,
故答案为:高铁酸钾具有强氧化性,能杀菌消毒,且消毒过程中自身被还原成铁离子,铁离子水解氢氧化铁胶体能吸附除去水中的悬浮杂质.
点评 本题考查氧化还原反应,为高频考点,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1 的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由C2H4和C3H4 组成的混合气体中含有氢原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
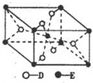
 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
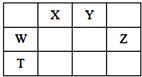 如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素的单质不具有半导体的特性,T与Z元素可形成化合物TZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与氢氧化钠溶液反应 | B. | 使溴的四氯化碳溶液褪色 | ||
| C. | 与金属钠反应放出氢气 | D. | 使高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
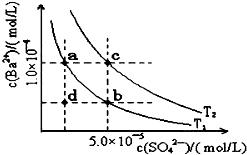 已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )
已知BaSO4(s)?Ba2+(aq)+SO4 2-(aq),25℃时Ksp=1.07×10-10,且BaSO4的随温度升高而增大.如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线,则下列说法不正确的是( )| A. | 温度为T1时,在T1曲线上方区域任意一点时,均有BaSO4沉淀生成 | |
| B. | 蒸发溶剂可能使溶液由d点变为T1曲线上a、b之间的某一点 | |
| C. | 升温可使溶液由b点变为d点 | |
| D. | T2>25℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com