
| A、28mL | B、42mL | C、56mL | D、84mL |


科目:高中化学 来源: 题型:
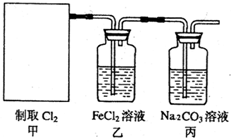 (2011?南京模拟)氯气是一种重要的化工原料.
(2011?南京模拟)氯气是一种重要的化工原料.
| ||
. |
| ||
. |
| ||
. |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.100 mL B.40 mL C.25mL D.20 mL
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高一上学期期末质检化学试卷(解析版) 题型:填空题
在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图)。随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭。
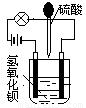
(1)该实验说明溶液的导电性与_________________有关。
(2)上述反应的离子方程式为_________________________________________。
(3)可以利用上述原理进行溶液浓度的测定。若烧杯中装有75mL 0.1mol/L Ba(OH)2溶液,当滴入25mL H2SO4时,电灯完全熄灭。试求该硫酸溶液的物质的量浓度。
(4)若用98%、1.84g/mL的浓硫酸配制上述浓度的硫酸溶液2500mL,需要多少毫升的浓硫酸(精确到0.1mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有25mL 0.2mol/L的Na2CO3溶液的试管中通过一支插到试管底部的长滴管,徐徐注入0.1mol/L盐酸75mL,在标况下,产生CO2气体体积为
A.28mL B.42mL C.56mL D.84mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com