
【题目】A是一种红棕色金属氧化物,B、D是金属单质。
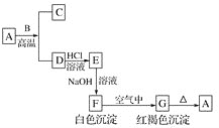
(1)写出下列物质的化学式:A________、E________、F________、G________。
(2)按要求写方程式:
①A+B→C+D的化学方程式:_________________________________;
②F→G的化学方程式:________________________________________________;
③E→F的离子方程式:________________________________________。
【答案】Fe2O3 FeCl2 Fe(OH)2 Fe(OH)3 2Al+Fe2O3![]() 2Fe+Al2O3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe2++2OH-===Fe(OH)2↓
2Fe+Al2O3 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe2++2OH-===Fe(OH)2↓
【解析】
A是一种红棕色金属氧化物,则A是Fe2O3,B、D是金属单质,A和B在高温下能反应生成金属单质D,则该反应是铝热反应,B是Al,D是Fe,C是Al2O3, G是红褐色沉淀,分解生成氧化铁,则G是Fe(OH)3,F是Fe(OH)2,铁和盐酸反应生成氯化亚铁和氢气,E和氢氧化钠溶液反应生成Fe(OH)2,则E是FeCl2,结合物质的性质分析解答.
(1)通过以上分析知,A、E、F、G分别是:Fe2O3、FeCl2、Fe(OH)2、Fe(OH)3,
故答案为:Fe2O3;FeCl2;Fe(OH)2;Fe(OH)3;
(2)①A是氧化铁,B是铝,二者在高温下发生铝热反应生成铁和氧化铝,反应方程式为:2Al+Fe2O3![]() 2Fe+Al2O3 ,故答案为:2Al+Fe2O3
2Fe+Al2O3 ,故答案为:2Al+Fe2O3![]() 2Fe+Al2O3 ;
2Fe+Al2O3 ;
②F是氢氧化亚铁,氢氧化亚铁不稳定,易被空气中氧气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③E是氯化亚铁溶液,与氢氧化钠溶液反应生成氢氧化亚铁和氯化钠,故离子方程式是Fe2++2OH-===Fe(OH)2↓;
故答案为:Fe2++2OH-===Fe(OH)2↓。


科目:高中化学 来源: 题型:
【题目】Ⅰ、有下列五种烃:①![]() ②
②![]() ③乙烷 ④戊烷 ⑤
③乙烷 ④戊烷 ⑤![]() ,其中互为同分异构体的是____________(填序号),②与⑤之间的关系为_____________,
,其中互为同分异构体的是____________(填序号),②与⑤之间的关系为_____________,
②③④⑤四种物质按它们的沸点由高到低的顺序排列正确的是_____________(填序号)
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:
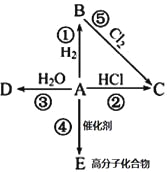
(1)写出A的电子式________,E的结构简式为______________
(2)写出下列反应化学方程式,并注明③⑤反应类型
② _____________________________________________
③ _____________________ ,反应类型________;
⑤ _____________________ ,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,如图所示是有关合成路线图.
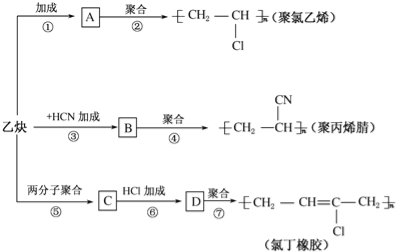
已知反应:nCH2═CH﹣CH═CH2![]()
![]()
请完成下列各题:
(1)写出物质的结构简式:A ,C .
(2)写出反应的化学方程式
反应②: ;
反应③: ;
反应⑥: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减轻大气污染,必须要加强对工业废气和汽车尾气的治理,根据所学知识回答下列问题:
(1)化石燃料包括煤、石油和________。
(2)酸雨是指pH____(填“>”“<”或“=”)5.6的降水,煤的燃烧是导致酸雨形成的主要原因,而正常雨水的pH约为5.6,原因是__________________ (用化学方程式表示)。
(3)煤的气化是高效、清洁利用煤的重要途径,可将煤炼成焦炭,再将焦炭在高温下与水蒸气反应生成一氧化碳和氢气的化学方程式为_________,该反应的基本类型是_________。
(4)在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的气体和无毒的气体,该反应的化学方程式为__________________。
(5)在新能源汽车未普及时,如图所示为一种“节能减排”的有效措施,以下对乙醇作汽车燃料的描述错误的是__________(填字母)。
![]()
A.原料来源丰富 B.是可再生能源 C.燃烧完全没有污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液分别滴定20.00mL浓度均为0.1mol·L-1的三种酸(HA、HB和HC)溶液,滴定的曲线如图所示,下列判断不正确的是
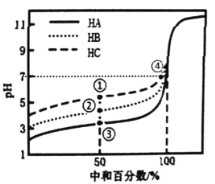
A.当中和百分数达50%时:![]()
B.滴定至①点时,溶液中:![]()
C.当中和百分数达100%时,消耗的NaOH溶液体积![]()
D.①和④所示溶液中都有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A. 钠着火燃烧产生苍白色火焰
B. 反应生成的大量白烟是氯化钠固体小颗粒
C. 棉球处发生的化学反应是: Cl2+2NaOH=NaCl+NaClO+H2O
D. 可在棉球右侧用湿润的淀粉碘化钾试纸判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用如图所示装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体,(图中夹持及尾气处理装置均已略去)回答下列问题:
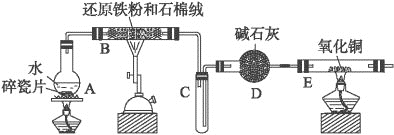
(1)装置B中发生反应的化学方程式是___;
(2)B、E两处酒精灯,必须后点燃的是___;
(3)该小组把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液里含有Fe3+,选用的试剂为__,现象是__。
②该实验小组同学用上述试剂没有检验到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化与氧化还原反应无关的是( )
A.向FeCl3溶液中滴加KSCN溶液,溶液变红
B.金属钠投入水中,有气体产生
C.将盛有氯气的试管倒扣在水中,水位上移
D.向H2S溶液中通入SO2气体,产生淡黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验(如图)。
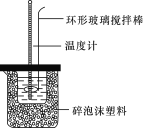
(1)量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还应加入的试剂是________(填序号)。
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
(2)在实验过程中,该同学需要测定并记录的实验数据有_____________(填序号)。
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.溶液混合后的最高温度
(3)若用50 mL 0.5 mol·L-1醋酸溶液代替上述盐酸测定中和热,所得数据_____________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com