
| 容器编号 | 温度/℃ | 容器体 积/L | 平衡时O2转化率 | 平衡时 压强/Pa |
| ① | 200 | V1 | 50% | p1 |
| ② | 200 | V2 | 70% | p2 |
| ③ | 350 | V3 | 50% | p3 |
| A. | 起始反应速率:③>①>② | |
| B. | 平衡时压强:p1>p2 | |
| C. | 容器体积:V1<V3 | |
| D. | 若实验②中O2和Cl2用量均加倍,则平衡时O2的转化率小于70% |
分析 A、根据温度高,压强大反应速率大判断;
B、根据②平衡时O2转化率比①大,说明平衡时②中气体的物质的量比①少;
C、③和①O2转化率的转化率相同,又该反应为吸热反应,③的温度高平衡向正反应方向移动,所以③的压强使平衡向逆反应方向移动,据此分析;
D、若实验②中O2和Cl2用量均加倍,相当于增大压强,平衡正向移动,则O2转化率大于70%.
解答 解:A、②平衡时O2转化率比①大,说明②相对于①平衡向正反应方向移动,所以开始时压强:p1<p2,则反应速率②>①,故A错误;
B、温度相同,②平衡时O2转化率比①大,说明平衡时压强:p1<p2,故B错误;
C、③和①O2转化率的转化率相同,又该反应为吸热反应,③的温度高平衡向正反应方向移动,所以③的压强使平衡向逆反应方向移动,即压强小于①,所以体积大于①,V1<V3,故C正确;
D、若实验②中O2和Cl2用量均加倍,相当于增大压强,平衡正向移动,则O2转化率大于70%,故D错误;
故选:C.
点评 本题考查外界条件对化学反应速率和平衡移动的影响,注意影响化学反应速率的因素与影响平衡移动的因素,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Z | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1mol任何气体物质的体积都约为22.4L | |
| B. | 1mol气体的体积约为22.4L | |
| C. | 标准状况下,1molO2和N2混合气(任意比)的体积约为22.4L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+CO2(g)?
(g)+CO2(g)? (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
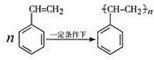 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com