
���� ����Fe+2HCl=FeCl2+H2��������2sĩ�ռ���H2 1.12L����״���£�����Ӧ�ֽ�����4s��Ӧ��5.6g���ۼ�������n��FeCl2������ѧ����ʽΪ��Fe+2HCl=FeCl2+H2��
2 sĩʱ��n��FeCl2��=n��H2��=$\frac{1.12L}{22.4L/mol}$=0.05 mol��
c��FeCl2��=$\frac{0.05mol}{0.1L}$=0.5 mol•L-1
4sĩʱ��n��FeCl2��=n��Fe��=$\frac{5.6g}{56g/mol}$=0.1 mol��c��FeCl2��=$\frac{0.1mol}{0.1L}$=1.0 mol•L-1
���v=$\frac{��c}{��t}$=$\frac{��n}{V•��t}$���ν��м��㡢�Ƚϣ�
��� �⣺��ѧ����ʽΪ��Fe+2HCl=FeCl2+H2��
2 sĩʱ��n��FeCl2��=n��H2��=$\frac{1.12L}{22.4L/mol}$=0.05 mol��
c��FeCl2��=$\frac{0.05mol}{0.1L}$=0.5 mol•L-1
4sĩʱ��n��FeCl2��=n��Fe��=$\frac{5.6g}{56g/mol}$=0.1 mol��c��FeCl2��=$\frac{0.1mol}{0.1L}$=1.0 mol•L-1
��1��ǰ2s�ڣ�v��FeCl2��=$\frac{��c��FeC{l}_{2}��}{��t}$=$\frac{0.5mol/L-0}{2s}$=0.25mol/��L•s����
�ʴ�Ϊ��0.25mol/��L•s����
��2����4 s�ڣ�v��FeCl2��=$\frac{��c��FeC{l}_{2}��}{��t}$=$\frac{1.0mol/L-0.5mol/L}{4s}$=0.125 mol/��L•s����
v��HCl��=2v��FeCl2��=0.125 mol/��L•s����2=0.25mol/��L•s����
�ʴ�Ϊ��0.25mol/��L•s����
��3��ѡ��v��FeCl2���Ƚϣ���Ϊ0.25 mol/��L•s����0.125mol/��L•s��������ǰ2 s�ڷ�Ӧ���ʿ죬��Ϊ��ʱHCl��Ũ�ȸߣ�Ũ��Խ�ߣ�����Խ�죬
�ʴ�Ϊ��ǰ2s�죬��Ϊ��ʱHCl��Ũ�ȸߣ�Ũ��Խ�ߣ�����Խ�죮
���� ���⿼���˻�ѧ��Ӧ���ʵļ��㣬�ۺ��Խ�ǿ��ͨ����ѧ����ʽ�����2min��6minʱ����n��FeCl2���ǽ���Ĺؼ�����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
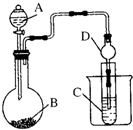
| A�� | ����A�����Ƴ���©�������� D������Ϊ���θ���� | |
| B�� | ��������װ����֤�ǽ����ԣ�Cl��S��װ��A��B��C����װҩƷӦ�ֱ�Ϊϡ���ᡢMnO2��Na2S��Һ | |
| C�� | ��������װ��֤���ǽ����ԣ�S��C��Si��װ��A��B��C����װҩƷӦ�ֱ�Ϊϡ���ᡢNa2CO3��Һ��Na2SiO3��Һ���۲쵽B�в������ݣ��Թ�C�г��ְ�ɫ�������������֤���ǽ����ԣ�S��C��Si | |
| D�� | װ��A��B��C����װҩƷӦ�ֱ�Ϊϡ���ᡢNa2CO3��Һ��Na2SiO3��Һ���۲쵽B�в������ݣ��Թ�C�г��ְ�ɫ�������������֤���ǽ����ԣ�Cl��C��Si |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������Ũ�� | B�� | ����ѹǿ | C�� | ��߷�Ӧ���¶� | D�� | �����۴�����Ƭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | þ��ȼ�շ�Ӧ | B�� | �������������Ƶķ�Ӧ | ||
| C�� | ˮ�ķֽⷴӦ | D�� | ��������ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��H+��=10-6 mol•L-1����Һһ�������� | |
| B�� | PH=7����Һһ�������� | |
| C�� | c��OH-��=c��H+������Һһ�������� | |
| D�� | ����ʹ��̪��Һ������Һһ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ˮϡ�ͺ���Һ��$\frac{c��N{{H}_{4}}^{+}��}{c��N{H}_{3}•{H}_{2}O��}$��ֵ��С | |
| B�� | 0.1 mol•L-1Na2CO3��Һ������ˮϡ�ͣ�CO32-��ˮ��̶�������Һ��pH��С | |
| C�� | 298 Kʱ��2H2S��g��+SO2��g���T3S��s��+2H2O��l�����Է����У������H��0 | |
| D�� | ��N2��g��+3H2��g���T2NH3��g����������������ʱ����N2������Ӧ���������淴Ӧ���ʼ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | ��״ | �۵㣨�棩 | �е㣨�棩 | �ܶȣ�g/mL�� | �ܽ��� | |
| ˮ | �Ҵ� | |||||
| �ױ� | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.8669 | ���� | ���� |
| ������ | ��ɫƬ״����״���� | 112.4 ��100������������ | 248 | 1.2659 | �� | ���� |
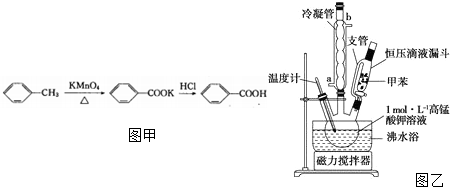
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
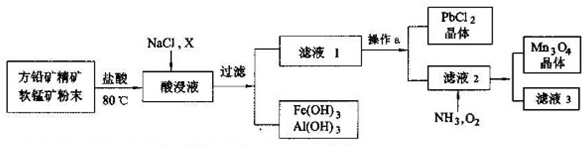
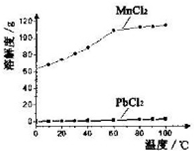
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com