
某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )
|
| A. | 分子中的C、H、O的个数比为1:2:3 |
|
| B. | 分子中C、H个数比为1:2 |
|
| C. | 该有机物的相对分子质量为14 |
|
| D. | 该分子中肯定不含氧元素 |
考点:
测定有机物分子的元素组成.
专题:
烃及其衍生物的燃烧规律.
分析:
本题中只知道生成的水和二氧化碳的物质的量比,所以可以据此可以求算出其中碳原子和氢原子的个数比,但是不能判断其中氧原子与碳原子及氢原子的个数比,然后结合质量守恒定律即可完成判断.
解答:
解:A、根据质量守恒定律可以判断在有机物中含有碳原子和氢原子,但是不能判断出该有机物中是否含有氧元素,所以也就无从求算其该有机物中碳氢氧三种原子的个数比,故A错误;
B、根据题意可以知道生成的水和二氧化碳的物质的量比为1:1,即生成的水和二氧化碳的分子个数相等,而一个水分子中含有2个氢原子,一个二氧化碳分子中含有一个碳原子,即该有机物中碳原子和氢原子的个数比为1:2,故B正确;
C、根据题意只能确定该有机物中碳原子和氢原子的个数比,不能判断出该有机物中是否含有氧元素,就不能确定有机物的分子式以及相对分子式量的大小,故C错误;
D、根据质量守恒定律可以判断在有机物中含有碳原子和氢原子,但是不能判断出该有机物中是否含有氧元素,故D错误.
故选:B.
点评:
本题较好的考查了学生的分析计算能力和对元素守恒以及质量守恒的运用,属于很典型的习题,但对氧元素的确定容易出错.


科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:简答题
[化学——选修2]化学与技术:(15分)硫酸是重要的工业原料.工业上生产硫酸主要分为造气、催化氧化、吸收三个阶段,其生产流程图如下:
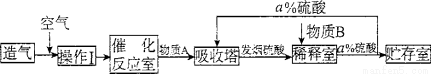
(1)操作I的内容是 ,此操作目的是 .物质B是 .a= 。
(2)工业上既可用硫黄也可用硫铁矿(FeS2)造气,若使用硫铁矿造气.另一产物是一种常见的红棕色固体.写出用硫铁矿造气时反应的化学方程式 。
(3)催化反应室中的反应是一个气体体积缩小的反应.增大压强有利于反应向右进行.但实际生产却是在常压下进行的.原因是 。
(4)工业生产中常用氨一硫酸法进行尾气脱硫,以达到消除污染、废物利用的目的.用两个化学方程式表示其反应原理 。
(5)若用等质量的硫黄、FeS2生产硫酸.假设原料的总利用率均为90%.则二者得到硫酸的质量比为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
已知常温下,浓度均为0.1 mol·L-1的5种钠盐溶液pH如下表:
溶质 | Na2CO3 | NaClO | NaHCO3 | CH3COONa | NaHSO3 |
pH | 11.6 | 10.3 | 9.7 | 8.8 | 5.2 |
下列说法中正确的是
A.少量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=2H++ Cl-+SO42-
B.常温下,稀释CH3COOH或HClO溶液时,溶液中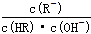 不变(HR代表CH3COOH或HClO)
不变(HR代表CH3COOH或HClO)
C.等体积、等物质的量浓度的Na2CO3、CH3COONa、NaHSO3三种溶液混合,溶液中:c(HSO3-)>c(CH3COO-)>c(CO32-)
D.含等物质的量的NaHCO3和CH3COONa的混合液中:c(OH-)—c(H+)=c(H2CO3)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
有4种碳架如下的烃,下列说法正确的是( )

①a和d是同分异构体
②b和c是同系物
③a和d都能发生加成反应
④只有b和c能发生取代反应.
|
| A. | ①④ | B. | ①② | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据所学知识填写下列空白.
(1)用系统命名法命名: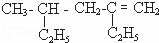 ;
;
(2)写出下列有机物的结构简式:2,6﹣二甲基﹣4﹣乙基辛烷: ;
(3)写出下列反应的化学方程式并分别指出其反应类型:
①将苯与浓硫酸和浓硝酸的混合液共热: ;反应类型为: ;
②1﹣丁烯与氯化氢反应: ;反应类型为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)⇌2C(g)达到平衡的标志的是( )
①C的生成速率是B的生成速率的 倍
倍
②单位时间生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④混合气体的总压强不再变化
⑤混合气体的物质的量不再变化
⑥单位时间消耗 a mol A,同时生成3a mol B
⑦A、B、C 的分子数目比为1:3:2.
|
| A. | ②⑦ | B. | ⑥④ | C. | ①③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有(NH4)2SO4和NH4NO3的混合溶液,向该混合溶液中逐滴加入Ba(OH)2溶液,并加热使之充分反应,直至Ba(OH)2溶液过量。加入Ba(OH)2溶液的体积与产生沉淀的质量和放出NH3的体积(标准状况下)的关系如下图,曲线a代表沉淀的质量变化,曲线b代表NH3的体积变化(假设NH3全部放出)。

(1)混合溶液中NH 的物质的量为________mol。
的物质的量为________mol。
(2)混合溶液中NO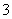 的物质的量为________mol。
的物质的量为________mol。
(3)当加入Ba(OH)2溶液的体积在100~200 mL范围内,发生反应的离子方程式为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com