
分析 (1)银镜反应的条件是在碱性条件下发生;
(2)能发生银镜反应的物质必含有醛基官能团,甲酸含有醛基,可以发生银镜反应;
(3)依据银镜反应的实验操作和注意问题分析判断;
(4)依据实验装置,实验过程,反应的原理产物性质分析;
(5)依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;
(6)根据甲醇性质分析,甲醇是有毒的易挥发的有机物;
(7)根据甲酸、甲醇的性质和饱和碳酸钠的作用解答;
(8)酯在碱溶液中水解生成酸盐和醇.
解答 解:(1)银镜反应的条件是在碱性条件下发生,在甲酸进行银镜反应前,必须在其中加入一定量的碱,可以加NaOH(Na2CO3)溶液,
故答案为:NaOH(Na2CO3)溶液;反应必须在碱性条件下发生;
(2)甲酸含有醛基,能发生银镜反应,发生反应HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O,
故答案为:HCOOH+2Ag(NH3)2OH $\stackrel{△}{→}$(NH4)2CO3+2Ag↓+2NH3↑+H2O;
(3)银镜反应的条件是在碱性条件下发生的,是在新制的银氨溶液中加入少量需要检验的有机物,水浴加热,生成银镜现象,反应过程中不能震荡,试管要洁净,银氨溶液需要新制,制备方法是想硝酸银溶液中加入氨水,生成沉淀,继续加入到沉淀恰好溶解得到银氨溶液,所以成功的做了银镜反应,
A、用洁净试管使银析出均匀,故A需要;
B、在浓度为2%的NH3•H2O中滴入稍过量的浓度为2%的硝酸银,滴加试剂顺序错误,需碱过量,故B不需要;
C、久置的银氨溶液会析出氮化银、亚氨基化银等爆炸性沉淀物,易反应危险.故C不需要;
D、银镜反应需要反应的条件是碱性条件,故D不需要;
E、为得到均匀的银镜,需要用水浴加热,故E不需要;
F、为得到均匀银镜,反应过程不能震荡,故F不需要;
故答案为:BCDEF;
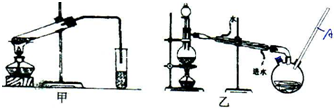
(4)乙装置中长导管A的作用是冷凝回流甲醇,平衡内外大气压强,
故答案为:冷凝回流甲醇,平衡内外大气压强;
(5)甲酸和甲醇进行酯化反应的历程是羧酸脱羟基醇脱氢,反应化学方程式为:HCOOH+CH3OH$→_{△}^{浓硫酸}$HCOOCH3+H2O,
故答案为:HCOOH+CH3OH$→_{△}^{浓硫酸}$HCOOCH3+H2O;
(6)甲醇是有毒的易挥发的有机物,需要密封装置中进行,所以选择乙,冷凝效果好,减少了甲醇等有毒物质对大气的污染,
故答案为:乙;冷凝效果好,减少了甲醇等有毒物质对大气的污染;
(7)甲酸和甲醇沸点低,易挥发,需用碎瓷片(沸石),为了降低了甲酸甲酯的溶解度,同时还能除去混有的甲醇和甲酸,需用饱和碳酸钠溶液,
故答案为:饱和碳酸钠溶液;碎瓷片(沸石);
(8)用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,是因为甲酸甲酯在NaOH溶液中发生水解,生成甲酸钠和甲醇,得不到酯,
故答案为:强碱性条件下,甲酸甲酯水解了.
点评 本题考查了有机物性质的应用、实验操作的步骤、注意问题、试剂选择、反应现象、装置的分析等,掌握醛基检验的实验方法判断,装置的原理应用是解答的关键,题目难度中等.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
 如图是一个化学过程的示意图.请根据该示意图完成下列题目:
如图是一个化学过程的示意图.请根据该示意图完成下列题目:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
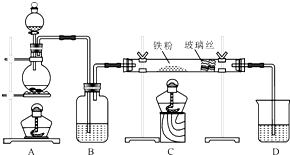 工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.
工业上,向500℃~600℃的铁屑中通入氯气生产无水氯化铁(已知炽热铁屑与氯化氢生成氯化亚铁).现用如图所示的装置模拟上述过程进行试验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图是实验室制乙酸乙酯的装置.
图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸* | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| |温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于制备硅胶和木材防火剂 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com