
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法正确的是
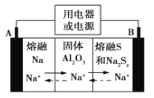
A.电子流向:A电极→用电器→B电极→电解质→A 电极
B.充电时,电极B与外接电源正极相连,电极反应式为 Sx2--2e-=xS
C.若用该电池在铁器上镀锌,则铁器应与B电极相连接
D.若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g
【答案】B
【解析】
试题分析:根据图片知,放电时,Na失电子发生氧化反应,所以A作负极、B作正极,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,充电时A为阳极、B为阴极,阴极、阳极电极反应式与负极、正极反应式正好相反,放电时,电解质中阳离子向正极移动、阴离子向负极移动;A.电池工作时,电子在外电路由负极向正极移动,电解质中只有阴、阳离子移动,故A错误;B.充电时,B是阳极与电源正极相连,电极反应式为 Sx2--2e-=xS,故B正确;C.电镀时,镀层金属作阳极,待镀金属铁为负极,应与电池的A极相连接,故C错误;D.电解精炼铜时,阳极为粗铜,溶解的是铜和比铜活泼的金属,电路中转移1mol电子时,阳极质量不为32 g,故D错误;答案为B。


科目:高中化学 来源: 题型:
【题目】CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→ +H2O,下列有关三聚氰胺的说法正确的是
+H2O,下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3
B.属于共价化合物
C.分子中既含极性键,又含非极性键
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是

A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫![]() 广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱羰基硫中的硫,其中氢解和水解反应是两种常用的脱硫方法,
广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱羰基硫中的硫,其中氢解和水解反应是两种常用的脱硫方法,
其反应式分别为:
①氢解反应:![]()
![]()
![]()
![]()
②水解反应:![]()
![]()
![]()
请回答下列问题:
(1)![]() 和
和![]() 能反应生成
能反应生成![]() 和
和![]() ,写出该反应的热化学方程式_______。
,写出该反应的热化学方程式_______。
(2)水解反应达到平衡后,若减小容器的体积,逆反应速率将______![]() 填增大、减少或不变,下同
填增大、减少或不变,下同![]() ,COS的转化率______。
,COS的转化率______。
(3)某温度下,体积为2L的恒容体系中,物质的量分别为m、n的COS蒸气和![]() 气发生氢解,已知COS的转化率为
气发生氢解,已知COS的转化率为![]() ,则该温度下的平衡常数表达式
,则该温度下的平衡常数表达式![]() ________________________
________________________![]() 用m、n、
用m、n、![]() 等符号表示
等符号表示![]() 。
。
(4)某科研小组研究改进催化剂![]() 和温度对COS水解的影响,得到如图
和温度对COS水解的影响,得到如图

COS水解的最佳温度是__________________;理由是__________________________。
(5)研究表明,用金属储氢材料![]() 、白金
、白金![]() 、硫酸溶液组成的原电池可以发生羰基的氢解而脱硫处理。写出原电池的正极反应式____________________;
、硫酸溶液组成的原电池可以发生羰基的氢解而脱硫处理。写出原电池的正极反应式____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是
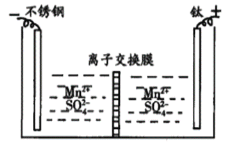
A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2) 与NH3相似,水溶液呈碱性,25℃时,向10mL0.1mol·L-1乙二胺溶液中滴加0.1 mol·L-1盐酸,各组分的物质的量分数δ随溶液pH的变化曲线如图所示,下列说法错误的是
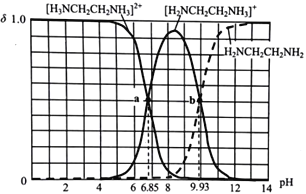
A. 混合溶液呈中性时,滴加盐酸的体积小于10mL
B. Kb2[H2NCH2CH2NH2] 的数量级为10-8
C. a 点所处的溶液中:c(H+)+3c([H3NCH2CH2NH3]2+)=c(OH-) +(Cl-)
D. 水的电离程度:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)命名下列有机物:HOCH2CH2CHO_____, ________。
________。
(2)燃烧某有机物A 1.50 g,生成1.12 L(标准状况)CO2和0.05 mol H2O,该有机物的蒸气对空气的相对密度是1.04,则该有机物的分子式为_____。
(3)已知端炔烃在催化剂存在下可发生偶联反应:2RC≡CH![]() RC≡C—C≡CR+H2,称为Glaser反应,回答下列问题:
RC≡C—C≡CR+H2,称为Glaser反应,回答下列问题:
已知: ,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
,该转化关系的产物E(C16H10)的结构简式是_______,用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AgCl的沉淀溶解平衡为AgCl(s)![]() Ag+(aq)+Cl(aq),下列说法中错误的是( )
Ag+(aq)+Cl(aq),下列说法中错误的是( )
A.向AgCl悬浊液中加少量水,c(Ag+)一定减小
B.AgCl饱和溶液中c(Ag+)=![]() mol/L
mol/L
C.用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失
D.反应AgCl+NaBr=AgBr+NaCl易进行,说明溶解度:AgCl>AgBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

(1)反应Ⅰ的化学方程式是______________________________________
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
则SO3(g)分解的热化学方程式为____________________。
(3)L(L1、L2)、X可分别代表压强或温度其中之一。如图表示L一定时,ii中SO3(g)的质量分数随X的变化关系。

①X代表的物理量是__________。
②判断L1、L2的大小关系:L1_______L2,并简述理由:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com