

分析 硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),烧渣在硫酸溶液中通入足量氧气,反应后过滤得到固体W和溶液X,溶液X加入铁反应生成硫酸亚铁,蒸发浓缩结晶析出得到绿矾,溶液X中加入试剂调节溶液PH得到溶液Z加热制备聚铁胶体得到聚铁,(1)过程②产生的气体为SO2,具有还原性和漂白性;
(2)根据反应物和生成物的种类结合质量守恒书写化学方程式;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+;
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器;
(5)过程⑤调节pH应使溶液碱性增强,有利于聚铁的生成;
(6)过程⑤⑥目的为促进的水解,加热有利于水解的进行;
(7)根据n(Fe3+)=n(SO42-)计算.
解答 解:(1)过程②产生的气体为SO2,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性KMnO4溶液、溴水褪色,故答案为:ACD;
(2)反应物为FeS、O2和H2SO4,生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,
反应的化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,
故答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+,加入铁可生成Fe2+,并且不引入新的杂质,
故答案为:Fe(或铁);
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器,可能还需要泥三角,故答案为:蒸发皿、玻璃棒;
(5)过程⑤调节pH应使溶液碱性增强,有利于聚铁的生成,
A.加入硫酸不能使溶液PH增大,故A错误;
B.加入碳酸钙生成微溶的硫酸钙,会引入新的杂质,故B错误;
C.加入NaOH可使溶液碱性增强,生成的聚铁中不引入新的杂质,故C正确.
故答案为:C;
(6)过程⑤⑥目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,
故答案为:促进Fe3+的水解;
(7)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀,
n(BaSO4)=$\frac{3.495g}{233g/mol}$=0.015mol,
则n(Fe3+)=n(SO42-)=0.015mol,
m(Fe)=0.015mol×56g/mol=0.84g,
ω(Fe)=$\frac{0.84g}{2.7g}$=31.1%,
故答案为:31.1%.
点评 本题考查较为综合,涉及物质含量的测定、制备实验方案的设计等知识,题目难度较大,注意常见化学实验操作方法.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
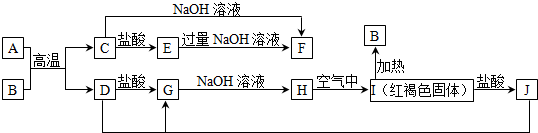
金牌课堂练系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
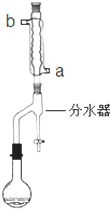 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
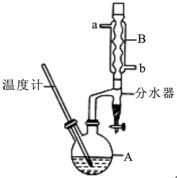 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的能量一定高于N | |
| B. | X、Y的能量总和高于M、N的能量总和 | |
| C. | 因为该反应为放热反应,故不必加热就可发生 | |
| D. | 断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com