
【题目】高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 . 已知K2MnO4溶液显绿色.请回答下列问题:
3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3 . 已知K2MnO4溶液显绿色.请回答下列问题:
(1)MnO2熔融氧化应放在中加热(填仪器编号).①烧杯②瓷坩埚③蒸发皿④铁坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒.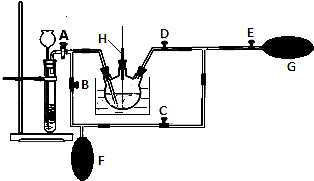
①为了能充分利用CO2 , 装置中使用了两个气囊.当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A,打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中.待气囊F收集到较多气体时,关闭旋塞 , 打开旋塞 , 轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中.然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应.
②检验K2MnO4歧化完全的实验操作是 .
(3)将三颈烧瓶中所得产物进行抽滤,将滤液倒入蒸发皿中,蒸发浓缩至 , 自然冷却结晶,抽滤,得到针状的高锰酸钾晶体.本实验应采用低温烘干的方法来干燥产品,原因是 .
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:2MnO4﹣+5C2O42﹣+16H+=2Mn2++10CO2↑+8H2O现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用移液管量取25.00mL待测液,用0.1000molL﹣1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为(保留4位有效数字,已知M(KMnO4)=158gmol﹣1).若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则测定结果将(填“偏大”、“偏小”、“不变”)
【答案】
(1)④
(2)AC;BCE;用玻璃棒蘸取三颈烧瓶内的溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全
(3)溶液表面出现晶膜为止;高锰酸钾晶体受热易分解
(4)87.23%;偏小
【解析】解:(1)熔融固体物质需要在坩埚内加热,加热熔融物中含有碱性KOH,瓷坩埚中含有二氧化硅,二氧化硅能够与氢氧化钾反应,所以应用铁坩埚,所以④正确,所以答案是:④;(2)①待气囊F收集到较多气体时,需要将气囊F中二氧化碳排出到热K2MnO4溶液中,所以需要关闭A、C,打开B、D、E,轻轻挤压气囊F,从而使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中,所以答案是:A、C;B、D、E;②由于K2MnO4溶液显绿色,所以用玻璃棒蘸取三颈烧瓶内的溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全,所以答案是:用玻璃棒蘸取三颈烧瓶内的溶液点在滤纸上,若滤纸上只有紫红色痕迹,无绿色痕迹,表明反应已歧化完全;(3)蒸发溶液获得高锰酸钾时不能蒸干,避免固体飞溅及高锰酸钾的分解,所以应该加热到溶液表面出现晶膜时停止加热,并且应采用低温烘干的方法来干燥产品,避免高锰酸钾晶体受热发生分解,所以答案是:溶液表面出现晶膜为止;高锰酸钾晶体受热易分解;(4)50mL0.1000molL﹣1草酸钠标准溶液中含有草酸钠的物质的量为:0.1mol/L×0.05L=0.005mol,根据反应2MnO4﹣+5C2O42﹣+16H+═2Mn2++10CO2↑+8H2O可知,消耗0.005mol草酸钠需要消耗高锰酸根离子的物质的量为:0.005mol× ![]() =0.002mol,500mL配制的样品溶液中含有高锰酸根离子的物质的量为:0.002mol×
=0.002mol,500mL配制的样品溶液中含有高锰酸根离子的物质的量为:0.002mol× ![]() =0.04mol,则样品中含有高锰酸钾的质量为:0.04mol×158gmol﹣1=6.32g,则高锰酸钾产品的纯度为:
=0.04mol,则样品中含有高锰酸钾的质量为:0.04mol×158gmol﹣1=6.32g,则高锰酸钾产品的纯度为: ![]() ×100%=87.23%;若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则导致待测液浓度减小,滴定时消耗的标准液体积偏小,测定结果偏小,所以答案是:87.23%;偏小.
×100%=87.23%;若移液管用蒸馏水洗净后没有用待测液润洗或烘干,则导致待测液浓度减小,滴定时消耗的标准液体积偏小,测定结果偏小,所以答案是:87.23%;偏小.


科目:高中化学 来源: 题型:
【题目】某金属氯化物MCl2 27g,含有0.40molCl-,则该氯化物的物质的量为______,摩尔质量为___________,金属M的相对原子质量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某补铁剂中含+2、+3价铁元素,欲用比色法测定其中铁元素的含量,应向样品溶液中加入试剂后,再与标准比色液对比,应加入的试剂是( )
A.足量KMnO4溶液,KSCN溶液
B.足量氯水,KSCN溶液
C.足量H2SO4溶液,KSCN溶液
D.足量H2O2溶液,KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应A(g)+B(g)xC(g),有如图所示的关系曲线,根据下图下列判断正确的是( ) 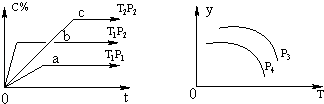
A.p3>p4 , y轴表示A的转化率
B.p3<p4 , y轴表示混合气体的密度
C.p3<p4 , y轴表示B的质量分数
D.p3<p4 , y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 .
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成原理为:N2(g)+3H2(g)2NH3(g);△H=﹣92.4KJmol﹣1 . 现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图. 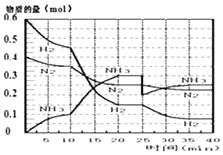
回答下列问题:
(1)10min内以NH3表示的平均反应速率;
(2)在10~20min内:NH3浓度变化的原因可能是;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡的时间范围为: , 第1次平衡:平衡常数K1=(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)2NH3(g)+ ![]() O2(g);△H=a kJmol﹣1
O2(g);△H=a kJmol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a0;△S0,(填“>”、“<”或“=”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的叙述正确的是( )
A.高聚物的相对分子质量一定为单体相对分子质量的整数倍
B.![]() 分子中只存在羧基、羟基两种官能
分子中只存在羧基、羟基两种官能
C.PETG的结构简式为: ![]() 合成PETG的单体有4种
合成PETG的单体有4种
D.![]() 分子中至少有16个原子共平面
分子中至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种重要的医药中间体,其合成路线如图: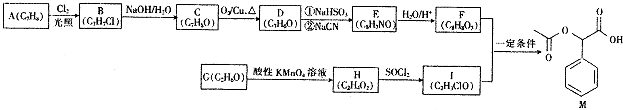
已知: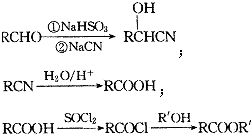 ;
;
回答下列问题:
(1)A的名称是 , F中所含官能团的名称是;
(2)C→D的反应类型为 , H→I的反应类型为;
(3)E的结构简式为;
(4)F+I→M的化学方程式为
(5)F的同分异构体中,符合下列条件的共有种.①能与FeCl3溶液发生显色反应
②能发生水解反应
③苯环上只有两个取代基
其中核磁共振氢谱显示有5组峰,且峰面积之比为1:1:2:2:2的是(填结构简式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com