




 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.若周期表中第七周期完全排满共有32种元素 |
| B.周期表中共有18个列,其中形成化合物种类最多的在第14列 |
| C.在氯化钠和氯化铯晶胞中阳离子的配位数分别为8和6 |
| D.在二氧化碳晶胞中每个二氧化碳分子周围紧邻二氧化碳分子有12个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A. 6Li和7Li的电子数相等,中子数也相等 |
| B.13C和14C属于同一种元素,它们互为同位素 |
| C.1H和2H是不同的核素,它们的质子数相等 |
| D.14C和14N的质量数相等,它们的中子数不等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
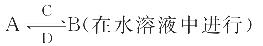
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
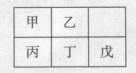
| A.原子半径:丙<丁<戊 |
| B.元素金属性:甲>丙 |
| C.氢氧化物碱性:丙<丁<戊 |
| D.丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a、b、e、d、c | B.e、d、a、b、c |
| C.b、a、e、d、c | D.a、b、d、c、e |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Na>Mg>Al>H |
| B.热稳定性: HC l<H2S<PH3 |
| C.酸性强弱:H2SiO3<H2CO3<H3PO4 |
| D.氧化性:K+<Na+<Mg2+<Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.10B20是一种新型化合物 | B.10B的中子数和核外电子数相等 |
| C.10B20晶体熔点高,硬度大 | D.10B和10B20互为同位素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com